Масла и смазки применяемые на погрузчиках-экскаваторах JCB 3CX, 4CX.
Наш новый магазин на Троицком тракте 62И ТК ИСКРА 1 этаж! Специально для погрузчика-экскаватора фирмы JCB мы подготовили подбор масел по допускам завода-изготовителя согласно технических условий. Согласно этих допусков вы можете подобрать наиболее качественное масло марки Liqui Moly (Ликви Моли, Германия) и оригинальное JCB которое прослужит долго и надежно для вашей спецмашины. |
1. В двигатель масло подбирается по исполнению машин, одной из ходовых версий являются 4*2 и 4*4 приводные модели с 2010 года, заправочная емкость 12-15л.
Разливное синтетическое моторное масло JCB Extreme Perfomance 5W-40 4001/2703E. Синтетическое моторное масло JCB Extreme Perfomance 5W-40 4001/2703E — это масло, которое отличается высокими эксплуатационными характеристиками и обеспечивает защиту от износа при низкой температуре. | |
Всесезонное синтетическое моторное масло Top Tec Truck 4050 10W-40 (для Euro IV, V, VI (DPF/CRT)) в фасовке 5, 20, 205 литров. Великолепно защищает от износа и обеспечивает оптимальную чистоту двигателя. Рекомендуется использовать только для дизельных двигателей. | |
Всесезонное синтетическое моторное масло Super Leichtlauf Famo R SAE 10W-40, Современное универсальное легкотекучее всесезонное моторное масло для применения в смешанных парках. | |
Минеральное моторное масло Motorenoil Performance Top Trans R SAE 15W-40, в фасовке 5, 20, 205 литров. Современное универсальное моторное масло для всех типов двигателей. |
2. Гидравлическая система:
Емкость 130 литров.
Разливное гидравлическое масло JCB Hydraulic Fluid High Perfomance 32 4002/1024E. Гидравлическое масло JCB Hydraulic Fluid High Perfomance — оригинальное гидравлическое масло с новой технологией содержания антиокислительных присадок и отличной защитой от износа. | |
Минеральное масло Hydraulikoil HLP R 32 Минеральное гидравлическое масло HLP предназначено для использования в гидравлических системах в качестве рабочей жидкости. Содержит присадки, повышающие стойкость к старению, антикоррозионные присадки и противоизносные. | |
Минеральное масло Hydraulikoil HLP R 46 Минеральное гидравлическое масло HLP предназначено для использования в гидравлических системах в качестве рабочей жидкости. Содержит присадки, повышающие стойкость к старению, антикоррозионные присадки и противоизносные. |
3. Точки смазки / масленки:
| Высокотемпературная смазка для подшипников Lithium-Komplexfett LX2P, в фасовке 0,4, 5, 15 кг. Для смазки в подшипниках скольжения и роликовых подшипниках условиях высоких температур и экстремальных нагрузок. | |
| Высокотемпературная смазка для ступиц подшипников LM 50 Litho HT, в фасовке 0,4, 5, 25 кг. Высокотемпературная консистентная литиевая смазка, содержащая высокоэффективные противозадирные присадки. Устойчивая к размягчению, окислению, с антикоррозионными свойствами, водостойкая. |
4. В систему охлаждения заливается синий антифриз G11 либо в готовом виде, либо концентрат с разведением, ёмкость 17,5 — 18,5 литров.
Синий антифриз Universal Kuhlerfrostschutz GTM 11 Готовая к применению высококачественная охлаждающая жидкость. | |
| Антифриз-концентрат Kuhlerfrostschutz KFS 2000 G11 синий Концентрат. Необходимо разведение с дистилированной водой в соответствии с необходимой пропорцией. |
5. Колесные редукторы, спереди. Емкость 2 литра каждая ступица.
6. Гидротрансформатор:
Специализированная жидкость от производителя.
7. Передний дифференциал / задний дифференциал.
Специализированная жидкость от производителя.
Масло в коробку JCB 3CX замена
В компании «Техноуникум» вы всегда можете трансмиссионное и моторное масло для JCB 3CX в Санкт-Петербурге. Есть в наличии масла для переднего, заднего моста, АКПП. Осуществляем продажу ГСМ, которые официально рекомендует завод-изготовитель, а также качественных аналогов. При возникновении трудностей с подбором смазочных материалов для JCB 3CX наши менеджеры всегда вам помогут.
Масло для коробок JCB: рекомендации завода-изготовителя
Производитель JCB рекомендует следующие масла в зависимости от назначения:
- Синхрочелнок. Для техники JCBс приводом на 2 колеса используется масло JCB Special Transmission Fluid (по международной спецификации – ESP-M2C 33G).

- Передний мост. Рекомендуется использовать JCB HD90 Gear Oil (API-GL-5) или Special Gear Oil Plus (API-GL-4) в зависимости от наличия или отсутствия дифференциала ограничения пробуксовки.
- Задний мост. Масло для заднего моста JCB 3CXдолжно удовлетворять условиям использования с дифференциалами ограничения пробуксовки и работе с масляно-иммерсионными тормозными системами.
Обратите внимание, что в мостах JCBAWS, имеющих ограниченный дифференциал скольжения, необходимо использовать масло JCB Special Gear Oil Plus.
В АКПП допускается использование жидкости JCBUniversal ATF – GM Dextron-III, Allison C4. Общий объем масла в коробке АКПП составляет 15 литров, в переднем мосту – 13-18 литров (в ступицах 8 литров), в заднем мосту – 23 литра (корпус 18 л, ступицы – 8 л).
Что учесть при выборе трансмиссионного масла для 3CX
Учтите, что трансмиссионное масло (коробка, мосты) для спецтехники JCB должно удовлетворять требованиям по основным параметрам (вязкость, состав и др. ) и иметь требуемые для надежной работы трансмиссии физико-химические характеристики. При использовании трансмиссионной жидкости, не соответствующей требованиям, предъявляемым производителем, возможно снижение ресурса и серьезные поломки трансмиссии.
) и иметь требуемые для надежной работы трансмиссии физико-химические характеристики. При использовании трансмиссионной жидкости, не соответствующей требованиям, предъявляемым производителем, возможно снижение ресурса и серьезные поломки трансмиссии.
Масло расходуется в АКПП, переднем и заднем мосту JCB неравномерно – приблизительный расход и частота замены, указываемые заводом-изготовителем, могут не соответствовать реальным данным. Реальный расход зависит от условий эксплуатации, своевременного технического обслуживания, года выпуска экскаватор-погрузчика.
Когда менять масло в коробке JCB
Масло JCB 3CX заменяется по достижению заданного ресурса (моточасов). После замены трансмиссионной жидкости обязательно заменяют масляный фильтр, даже в случае, если его состояние удовлетворительно. Это необходимо выполнять, поскольку в фильтре остаются мелкие абразивные частицы, металлическая стружка. Более того, новое масло может иметь другой состав – смешивание трансмиссионной жидкости недопустимо.
Несвоевременная замена смазочной жидкости в трансмиссии приводит к тому, что трущиеся детали работают на износ. При трении возникает перегрев элементов КПП, образуется нагар, металлическая стружка, которая негативно влияет на работу АКПП. В итоге может возникнуть необходимость в дорогостоящем ремонте сцепления, трансмиссии, а это простой техники, затраты на ремонтные работы и обслуживание. Поэтому рекомендуется своевременно менять масло, проверять его уровень.
В каталоге нашей компании вы найдете рекомендуемые к применению в АКПП, переднем и заднем мосту трансмиссионные смазочные материалы. Масло JCB 3CX соответствует всем требованиям, которые предъявляет производитель.
Покупая масло JCB для трансмиссии в компании «Техноуникум», вы получаете следующие выгодные условия:
- Большой ассортимент ГСМ для спецтехники JCB. Представлено только подходящее для экскаватор-погрузчика трансмиссионное масло.
- Выгодные цены. На ГСМ для JCB действуют выгодные цены – предлагаем убедиться в этом самостоятельно, ознакомившись с нашим прайсом.

- Поставка на объект заказчика, проведение технического обслуживания спецтехники. Можем доставить масло к вам на базу или строительный объект, выполнить выездную замену моторного масла JCB. Возможно заключение договора с юридическими лицами на обслуживание спецтехники, замену масел и других технических жидкостей по графику или состоянию.
Для уточнения интересующих вопросов звоните по телефону +7 (812) 24-11-778. Также вы можете оставить заявку через форму на нашем сайте – менеджеры свяжутся с вами в кратчайшие сроки.
Персональный сайт — Экскаватор-погрузчик JCB 4CX
Экскаватор-погрузчик JCB 4CX
Проходимость
Все модели JCB 4CX
Угол въезда — 74°
Угол при вершине препятствия между колесами — 118°
Угол съезда — 19°
Эксплуатационная масса
Эксплуатационная масса экскаватора-погрузчика JCB 4CX (Джисиби) с полным топливным баком и экскаваторным ковшом шириной 610 мм
JCB 4CX – 7950 кг, 4CX Super — 8130 кг (Ковш и фиксированная рукоять)
JCB 4CX – 8660 кг, JCB 4CX Super — 8880 кг (Ковш, вилы и телескопическая рукоять)
Маневренность
Рулевая система экскаватора-погрузчика JCB 4CX (Джисиби) полностью гидрофицированная. В случае остановки двигателя работает аварийная система рулевого управления.
В случае остановки двигателя работает аварийная система рулевого управления.
Предусмотрены три режима рулевого управления: поворот двух колес, поворот четырех колес в противоположные стороны и поворот четырех колес в одну сторону.
Режимы управления можно выбрать с помощью трехпозиционного переключателя на передней панели.
Все модели JCB 4CX
Управление мостами — Рулевое
Поворот руля от упора до упора, м – 2,75
Диметр поворота по внешним колесам (без торможения), м – 9,1
Диаметр поворота по краю ковша (без торможения), м – 10,7
Диметр поворота по внешним колесам (с торможением), м – 8,0
Диаметр поворота по краю ковша (с торможением), м – 9,5
Двигатель экскаватора-погрузчика JCB 4CX
Конструкция и расположение двигателя JCB 4CX обеспечивают беспрепятственный доступ ко всем узлам и агрегатам при проведении ежедневных проверок и проведении регламентных технических обслуживаний.
Тип топлива — Дизельное
Топливный фильтр — Сменные картриджи плюс сепаратор для отделения воды от дизельного топлива
Воздушный фильтр — Двухступенчатый циклонного типа с сухим элементом
Масляный фильтр и смазка — Полнопоточный
Охлаждающая система — Вентилятор под давлением 1 бар.
Двигатель JCB
Четырехцилиндровый двигатель с прямой впрыском топлива Stage II/III
Наддув — Турбонаддув / Турбонаддув и охладитель
Рабочий объем — 4,4 л
Количество цилиндров — 4
Внутренний диаметр цилиндра, мм — 103
Ход поршня, мм — 132
Номинальная частота вращения, об/мин — 2200
Полная мощность, л.с – 74,2
Максимальный крутящий момент, Нм – 425 / 440
Максимальный крутящий момент об/мин — 1300
Электрооборудование экскаватора-погрузчика JCB 4CX
Номинальное напряжение в бортовой сети — 12 В. Экскаватор-погрузчик JCB 4CX (Джисиби) оборудован электрической проводкой, специальными электрическими разъемами и щитком с плавкими предохранителями.
Электропроводка JCB 4CX рассчитана на тяжелые условия работы. Все разъемы соответствуют стандарту IP69 и изолированы о попадания в них пыли, воздействия воды и загрязнений.
На модели JCB 4CX установлены аккумуляторная батарея емкостью 110 А/ч и генератор переменного тока на 95 А, 2 галогенных дорожных фары, 4 передних и 4 задних регулируемых рабочих фары, 2 задних фонаря.
Контрольно-измерительные приборы включают в себя тахометр, датчик и указатель температуры охлаждающей жидкости, датчик и указатель уровня топлива, счетчик моточасов, часы.
На модели JCB 4CX установлена аудиовизуальная система звуковой и световой сигнализации уровня и давления масла в двигателе, состояния коробки передач, стояночного тормоза, аккумуляторной батареи, воздухоочистителя и генератора переменного тока.
Система фиксации крутящего момента JCB
Система фиксации крутящего момента позволяет оператору сократить время, а также экономить расход топлива.
На высших передачах включается система фиксации крутящего момента, которая позволяет избежать блокируемого трансформатора. При включении эта функция сокращает расход топлива и сокращает время движения.
Функция Torque Lock запускается автоматически на 4-й передаче (машина с коробкой передач Powershift), и на режиме „А” (машина с коробкой передач Autoshift).
Система фиксации крутящего момента экономит расход топлива до 25%, на 10% увеличивает скорость движения в гору, на 10% увеличивает вылет стрелы и позволяет машине передвигаться быстрее.
Данная функция не действительна на моделях с коробкой передач Synchroshuttle.
Задний мост JCB 4CX
Задний мост JCB разработан специально для установки на экскаваторах-погрузчиках и рассчитан на применение различных типов шин
Все модели JCB 4CX
Тип – планетарный редуктор JCB с пропорциональным крутящим моментом
Нагрузка на мосты, кг – 25000 (Статическая нагрузка) , 12500 (Динамическая нагрузка)
Передний мост JCB 4CX
Передний мост JCB разработан специально для установки на экскаваторах-погрузчиках и рассчитан на применение различных типов шин.
Все модели JCB 4CX
Тип – планетарный редуктор JCB с пропорциональным крутящим моментом
Самоблокирующийся дифференциал — Дополнительно
Нагрузка на мосты, кг
Статическая нагрузка — 25000
Динамическая нагрузка — 12500
Угол колебания — 16°
Коробки передач для моделей экскаватора-погрузчика JCB 4CX
Коробки передач КПП JCB спроектированы и рассчитаны специально для установки на экскаваторах-погрузчиках.
Синхронизированная, четырехскоростная коробка передач JCB Syncroshuttle c электрическим управлением гидротрансформатором позволяет на ходу плавно переключать передачи.
Коробка передач JCB Powershift с одним рычагом переключения передач и реверса на рулевой колонке. Один электрический переключатель передач и реверса позволяет быстро и плавно менять скорость и направления движения машины под нагрузкой.
КПП JCB
Тип — Powershift, Auto Powershift
Гидратрансформатор — 305 мм (12″) – все модели
Предаточное число — 2. 54:1 (все модели)
54:1 (все модели)
Передачи вперед/назад — 4/4 (Powershift ) / 6/4 (Auto Powershift)
Переключение передач — Powershift
Переключение реверса –Powershuttle
Колеса – 16,9х28
Скорость движения, км/ч
Powershift Auto Powershift
Передача 1 5 вперед / 5 назад 4,9 вперед / 6,2 назад
Передача 2 9,3 вперед / 9,3 назад 8,1 вперед / 8,4 назад
Передача 3 25,1 вперед / 25,1 назад 11 вперед / 22,4 назад
Передача 4 38,1 вперед / 38,1 назад 17,7 вперед / 30,5 назад
Передача 5 29,6 вперед
Передача 6 38,1 вперед
Кабина экскаватора-погрузчика JCB 4CX
Кабина экскаватора-погрузчика JCB 4CX (Джисиби) защищает оператора от падающих предметов и в случае опрокидывания машины. Большая площадь остекления (6,4 м ) и удачный дизайн кабины создают хороший обзор, обеспечивая безопасность оператора. Кабина соответствует стандартам ISO 3471 и 3449 (SAE J1040 b J231).
Большая площадь остекления (6,4 м ) и удачный дизайн кабины создают хороший обзор, обеспечивая безопасность оператора. Кабина соответствует стандартам ISO 3471 и 3449 (SAE J1040 b J231).
Регулируемое кресло на подвеске и удобное расположение рычагов управления. Уровень шума в кабине 73 дБ — самый низкий для машин данного класса. Радиосистема и магнитола с двумя акустическими колонками.
Доступ в кабину осуществляется через две большие двери, удобные для входа. Задние и боковые окна открываются полностью или частично. В составе оборудования кабины: ремень безопасности, 3-х скоростной обогреватель/обдуватель окон, стеклоочистители и омыватели переднего и заднего стекол, передний и задний звуковые сигналы, большие зеркала заднего вида, легко чистящийся пол.
Приборная панель расположена справа и оборудована дополнительной крышкой, которая защищает ее от повреждений. На панели находятся: указатель числа оборотов, счетчик моточасов, указатель уровня топлива, указатель температуры охлаждающей жидкости, цифровой счетчик пройденного пути, часы.
Кондиционер устанавливается в кабину дополнительно. Он обеспечивает отличное охлаждение, особенно, если работа осуществляется в странах с жарким климатом.
Механическая подвеска сиденья обеспечивает оператору дополнительный комфорт.
Система сервоуправления EasyControl
Система сервоуправления JCB упрощает работу оператора. Система сервоуправления EasyControl дает возможность оптимизировать скорость выдвижения штоков гидроцилиндров механизма обратной лопаты за счет автоматического переключения гидрораспределителя с двухпоточного режима на однопоточный в гидроконтуре обратной лопаты.
Система обеспечивает также лучшие характеристики обратной связи при перемещении оператором джойстика управления обратной лопатой из положения «замкнутый контур» в положение «открытый контур».
Дополнительный контроль
Advanced EasyControl является альтернативной системой гидравлического управления на экскаваторах-погрузчиках JCB 3CX и 4CX.
Данная система обеспечивает дополнительный комфорт оператора и высокую производительность. Данная опция в себя включает: вмонтированная в сиденье панель управления, которая позволяет управлять как экскаватором, так и погрузчиком; телескопическая рулевая колонка, обеспечивающая дополнительный комфорт.
Кроме того, Andanced EasyControl повышает эффективность потребления топлива, увеличивает скорость работы экскаватора и обеспечивает повышение эффективности и надежности.
Тормоза экскаватора-погрузчика JCB 4CX
Тормозная система JCB 4CX обеспечивает надежное и эффективное торможение машины. Саморегулирующиеся дисковые тормоза расположены в масляной ванне кратера моста, благодаря чему не перегреваются и обеспечивают эффективное торможение при большом сроке службы.
Торможение четырьмя колесами.
Педали тормоза обеспечивают более узкий радиус поворота и гарантируют отличную управляемость на скользкой поверхности.
Система автоматической компенсации обеспечивает прямое торможение.
Резервный аккумулятор обеспечивает максимальную безопасность в любых условиях и в случае, если сломан двигатель, применяет 4-х колесное торможение.
Увеличенный отступ в тормозном пакете уменьшает трение и позволяет экономить топливо.
Тормозная система экскаватора-погрузчика JCB 4CX (Джисиби) использует масло основной гидросистемы, что устраняет необходимость в отдельном резервуаре масла для тормозов.
Тормоза JCB 4CX имеют пропорциональное тормозное усилие по всему ходу педали.
Диаметр диска 220 мм, площадь трения одного тормоза 1290 кв.см.
Интегральный стояночный тормоз расположен на выходном валу коробки передач. Тормоз удерживает экскаватор-погрузчик на уклоне 1:3 и регулируется из кабины.
При выключении стояночного тормоза трансмиссия автоматически размыкается, что приводит к снижению износа накладных тормозных колодок. 5 тормозных дисков с внешним диаметром 127 мм. Площадь трения каждого диска 47,65 кв.см , общая площадь трения 476,5 кв.см.
Гидросистема экскаватора-погрузчика JCB 4CX
Стандартная гидравлическая система JCB 4CX «Открытый центр» с тремя шестеренными насосами и системой регулирования скорости и мощности гидропривода, которая при помощи регулирующего клапана автоматически меняет мощность гидропривода и скорость выполнения рабочих операций.
EcoDig – гидросистема с тремя гидронасосами обеспечивает такой же высокий поток и давление при более низких оборотах работы двигателя (1700 об/мин), что позволяет сократить потребление топлива на 15% без сокращения производительности (только на машинах с ручной коробкой передач или EasyControl).
Модулирующий клапан автоматически изменяет мощность гидропривода в соответствии с условиями копания в целях улучшения производительности – автоматически сбрасывает один насос, когда включена 4-ая передача на моделях с КПП Powershift.
Переключатель системы регулирования скорости и мощности гидропривода позволяет использовать гидравлику JCB 4CX в зависимости от различных задач.
Альтернативная система «Открытый центр» применяет высокоэффективный регулируемый аксиально-поршневой насос переменной производительности. Обе системы включают:
— простоту управления погрузчиком и экскаватором JCB 4CX, которая обеспечена благодаря малому усилию на рычагах и их удобному расположению.
— полнопоточный фильтр рабочей жидкости обеспечивает ее очистку от частиц крупнее 10 микрон.
Производительность насосов при 1700 об/мин (Система «Открытый центр» шестеренные насосы)
Насос 1 и 3 – 82 / 80 л/мин
Насос 2 – 73 / 64 л/мин
Производительность насосов при 2200 об/мин (Система «Закрытый центр» поршневые насосы)
Andanced EasyControl – 165 л/мин
Рабочее давление – 251 бар
Вспомогательные контуры JCB 4CX
Ручной гидравлический контур JCB позволяет использовать такие инструменты, как отбойные молотки, насосы и циркулярные пилы – также доступен на выдвижной катушке.
Контур JCB Hammer имеет возможность переключения между малым и высоким потоком, что позволяет использовать такое оборудование как молоты и уплотнители.
Система смещения каретки экскаваторного оборудования POWERSLIDE позволяет оператору с помощью специальной педали, установленной в кабине, и независимой гидравлической системы перемещать каретку с установленным на ней экскаваторным оборудованием в поперечном направлении по задней раме опор относительно продольно оси машины.
Система смещения каретки экскаваторного оборудования POWERSLIDE поставляется по отдельному заказу.
Технические характеристики экскаватора-погрузчика JCB 4CX, Contractor, Sitemaster (Ковш GP/ Ковш 6 в 1)
Основные размеры экскаватора-погрузчика JCB 4CX
Модель JCB 4CX
A — Габаритная длина, м — 5,91
B — Колесная база, м — 2,22
C — Расстояние от оси поворотной колонки до задней оси моста, м — 1,36
D — Дорожный просвет от опор, м — 0,34
E — Дорожный просвет от поворотной колонки, м — 0,50
F — Высота центра рулевого колеса, м — 1,88
G — Высота крыши кабины, м – 3,03
H — Габаритная высота, м — 3,54
J — Габаритная ширина, м — 2,36
K — Ширина ковша погрузчика, м — 2,33
Сила и грузоподъемность погрузчика JCB 3CX
Сила напора на кромке ковша, кгс — 6227 / 6590 (Ковш GP/ Ковш 6 в 1)
Сила напора на стреле, кгс — 5936 / 5730 (Ковш GP/ Ковш 6 в 1)
Номинальная грузоподъемность, кг — 4638 / 4378 (Ковш GP/ Ковш 6 в 1)
Макс. грузоподъемность 7’8», кгс — 3439 / 3169 (Ковш GP/ Ковш 6 в 1)
грузоподъемность 7’8», кгс — 3439 / 3169 (Ковш GP/ Ковш 6 в 1)
Сила сжатия челюстей, кгс — 2945 (Ковш 6 в 1)
Размеры погрузчика JCB 4CX
M — Высота выгрузки, м — 2,69 / 2,69
N — Высота горизонтального днища, м — 3,21 / 3,18
O — Высота оси шарнира ковша, м — 3,46 / 3,46
P — Вылет оси шарнира ковша, м — 0,41 / 0,41
Q — Вылет кромки ковша на уровне земли, м — 1,42 / 1,39
R — Максимальный вылет поднятого ковша, м — 1,21 / 1,17
S — Вылет поднятого ковша при выгрузке, м — 0,82 / 0,76
T — Глубина копания (толщина срезаемого слоя), м — 0,14 / 0,18
U — Угол запрокидывания ковша — 45° / 45°
V — Угол выгрузки — 45° / 45°
Ширина раскрытия челюстей, м – 0,95
Параметры вил JCB 4CX, Contractor, Sitemaster (Вилы на челюстном коше / Вилы на каретке)
Длина вил, м — 1,1 / 1,1
Ширина зуба, м — 0,08 / 0,08
Вылет вил на уровне земли, м — 2,68 / 2,13
Вылет вил на максимальной высоте, м — 2,30 / 1,76
Высота подъема, м — 2,90 / 3,28
Минимальное расстояние между вилами, м — 0,2 / 0,2
Максимальное расстояние между вилами, м — 2,17 / 1,03
Грузоподъемность, кг — 1000 / 2000
Размеры экскаватора JCB 4CX
Модель JCB 4CX (Стандартная рукоять)
Положение рукояти (только втянута)
A — Максимальная глубина копания – 4,67
Максимальная глубина копания при горизонтальном днище – 4,29
B — Максимальный вылет ковша от оси заднего моста – 6,74
C — Максимальный вылет ковша от оси поворотной колонки – 5,40
D — Вылет ковша от оси поворотной колонки при максимальной высоте подъема – 2,82
E — Максимальный вылет ковша от оси машины при повороте стрелы на 90 град. – 6,02
– 6,02
F — Максимальная высота подъема ковша – 5,45
G — Максимальная высота разгрузки – 3,84
H — Cмещение поворотной колонки при стандартной ширине рамы опор — 1,16
J — Угол поворота ковша — 201°
Модель JCB 4CX Contactor, Sitemaster (Телескопическая рукоять)
Положение рукояти (выдвинута / втянута)
A — Максимальная глубина копания – 5,53 / 4,32
Максимальная глубина копания при горизонтальном днище – 5,88 /4,67
B — Максимальный вылет ковша от оси заднего моста – 7,88 /6,74
C — Максимальный вылет ковша от оси поворотной колонки –6,54 / 5,40
D — Вылет ковша от оси поворотной колонки при максимальной высоте подъема –3,75 / 2,82
E — Максимальный вылет ковша от оси машины при повороте стрелы на 90 град. –7,16 / 6,02
F — Максимальная высота подъема ковша –6,26 / 5,45
G — Максимальная высота разгрузки –4,73 / 3,84
H — Cмещение поворотной колонки при стандартной ширине рамы опор — 1,16
J — Угол поворота ковша -201°
Усилия и грузоподъемность экскаватора JCB 4CX
Модель JCB 4CX (Стандартная рукоять)
Положение рукояти (только втянута)
Усилие на кромке ковша при копании ковшом, кгс :
— Гидроцилиндр поворота ковша закреплен на ближней проушине — 5431
— Гидроцилиндр поворота ковша закреплен на дальней проушине — 6324
Усилие на кромке ковша при копании рукоятью, кгс – 3217
Грузоподъемность на полном вылете без ковша, кг – 1584
Модель JCB 4CX Contactor, Sitemaster (Телескопическая рукоять)
Положение рукояти (выдвинута / втянута)
Усилие на кромке ковша при копании ковшом, кгс :
— Гидроцилиндр поворота ковша закреплен на ближней проушине — 5385
— Гидроцилиндр поворота ковша закреплен на дальней проушине — 6228
Усилие на кромке ковша при копании рукоятью, кгс – 2255 / 3225
Грузоподъемность на полном вылете без ковша, кг – 719 / 1451
Усилия и грузоподъемность экскаватора JCB 4CX
Модель JCB 4CX (Стандартная рукоять)
Положение рукояти (только втянута)
Усилие на кромке ковша при копании ковшом, кгс :
— Скорость — 5431
— Мощность — 6324
Усилие на кромке ковша при копании рукоятью, кгс – 3893
Грузоподъемность на полном вылете без ковша, кг – 2046
Модель JCB 4CX Contactor, Sitemaster (Телескопическая рукоять)
Положение рукояти (выдвинута / втянута)
Усилие на кромке ковша при копании ковшом, кгс :
— Скорость — 5385
— Мощность — 6228
Усилие на кромке ковша при копании рукоятью, кгс – 2729 / 3903
Грузоподъемность на полном вылете без ковша, кг – 1082 / 1885
Пощенска Банка
БЕЗ ИПОТЕКА * * Представените изчисления са само примерни и не представляват търговска оферта. Предназначението на калкулатора е да ти помогне да определиш твоите нужди от финансиране, както и да изчислиш бъдещите плащания по кредита, като резултатите и условията от изчисленията не обвързват банката. Изчислените от калкулатора стойности са илюстративни и могат да се различават от стойностите на конкретния кредит, който банката ще предложи. Примерните изчисления са валидни при константни стойности на параметрите по кредита за целия срок на договора, при анюитетни вноски. Месечната вноска представлява сбор от дължими главница и лихва за едномесечен период и не включва другите разходи по кредита. За да получиш подробна информация за кредитните продукти, предлагани от „Юробанк България“ АД, посети удобен за теб офис на банката или остави данните си за контакт във формата и наш представител ще се свърже с теб. Представителен пример: При кредит с размер 23 000 лв., срок 96 месеца, с 5.2% фиксирана годишна лихва за първите 12 месеца и 5.2% променлива годишна лихва за останалия период, при превод на работна заплата по разплащателна сметка по програма за комплексно банково обслужване «Моето Семейство» , с такса за откриване на разплащателна сметка по програмата 3 лв.
Предназначението на калкулатора е да ти помогне да определиш твоите нужди от финансиране, както и да изчислиш бъдещите плащания по кредита, като резултатите и условията от изчисленията не обвързват банката. Изчислените от калкулатора стойности са илюстративни и могат да се различават от стойностите на конкретния кредит, който банката ще предложи. Примерните изчисления са валидни при константни стойности на параметрите по кредита за целия срок на договора, при анюитетни вноски. Месечната вноска представлява сбор от дължими главница и лихва за едномесечен период и не включва другите разходи по кредита. За да получиш подробна информация за кредитните продукти, предлагани от „Юробанк България“ АД, посети удобен за теб офис на банката или остави данните си за контакт във формата и наш представител ще се свърже с теб. Представителен пример: При кредит с размер 23 000 лв., срок 96 месеца, с 5.2% фиксирана годишна лихва за първите 12 месеца и 5.2% променлива годишна лихва за останалия период, при превод на работна заплата по разплащателна сметка по програма за комплексно банково обслужване «Моето Семейство» , с такса за откриване на разплащателна сметка по програмата 3 лв. и месечна такса 7.85 лв., ползване на месечен пакет по застрахователна програма «Защита на плащанията» по потребителски кредит, такса за разглеждане на искане за кредит 400 лв., ГПР е 8.19%, месечната вноска е 293.37 лв., обща дължима сума 30 954.47 лв.
и месечна такса 7.85 лв., ползване на месечен пакет по застрахователна програма «Защита на плащанията» по потребителски кредит, такса за разглеждане на искане за кредит 400 лв., ГПР е 8.19%, месечната вноска е 293.37 лв., обща дължима сума 30 954.47 лв.
С ИПОТЕКА * * Представените изчисления са само примерни и не представляват търговска оферта. Предназначението на калкулатора е да ти помогне да определиш твоите нужди от финансиране, както и да изчислиш бъдещите плащания по кредита, като резултатите и условията от изчисленията не обвързват банката. Изчислените от калкулатора стойности са илюстративни и могат да се различават от стойностите на конкретния кредит, който банката ще предложи. Примерните изчисления са валидни при константни стойности на параметрите по кредита за целия срок на договора, при анюитетни вноски. Месечната вноска представлява сбор от дължими главница и лихва за едномесечен период и не включва другите разходи по кредита. За да получиш подробна информация за кредитните продукти, предлагани от „Юробанк България“ АД, посети удобен за теб офис на банката или остави данните си за контакт във формата и наш представител ще се свърже с теб. Представителен пример: При нов потребителски кредит, обезпечен с ипотека върху недвижими имот, с размер 20 000 лв., срок 120 месеца и 3,85% променлива годишна лихва, при финансиране до 70% от пазарната стойност на обезпечението, при превод на работна заплата по разплащателна сметка, по програма за комплексно банково обслужване «Моето семейство» с превод на работна заплата, с такса за разкриване на разплащателна сметка по програмата 3 лв. и месечна такса 7,85 лв., 130 лв. такса за оценка на кредитоспособността, 200 лв. такса за документален анализ на обезпечението, 150 лв. такса за оценка на обезпечение, с държавна такса за вписване на ипотека в размер на 0,1% от сумата на кредита. ГПР е 5.33%, месечната вноска е 203.86 лв., обща дължима сума 25 629.16 лв. Необходима е застраховка на ипотекираното имущество, сключване на договор за застрахователен пакет Живот.
За да получиш подробна информация за кредитните продукти, предлагани от „Юробанк България“ АД, посети удобен за теб офис на банката или остави данните си за контакт във формата и наш представител ще се свърже с теб. Представителен пример: При нов потребителски кредит, обезпечен с ипотека върху недвижими имот, с размер 20 000 лв., срок 120 месеца и 3,85% променлива годишна лихва, при финансиране до 70% от пазарната стойност на обезпечението, при превод на работна заплата по разплащателна сметка, по програма за комплексно банково обслужване «Моето семейство» с превод на работна заплата, с такса за разкриване на разплащателна сметка по програмата 3 лв. и месечна такса 7,85 лв., 130 лв. такса за оценка на кредитоспособността, 200 лв. такса за документален анализ на обезпечението, 150 лв. такса за оценка на обезпечение, с държавна такса за вписване на ипотека в размер на 0,1% от сумата на кредита. ГПР е 5.33%, месечната вноска е 203.86 лв., обща дължима сума 25 629.16 лв. Необходима е застраховка на ипотекираното имущество, сключване на договор за застрахователен пакет Живот.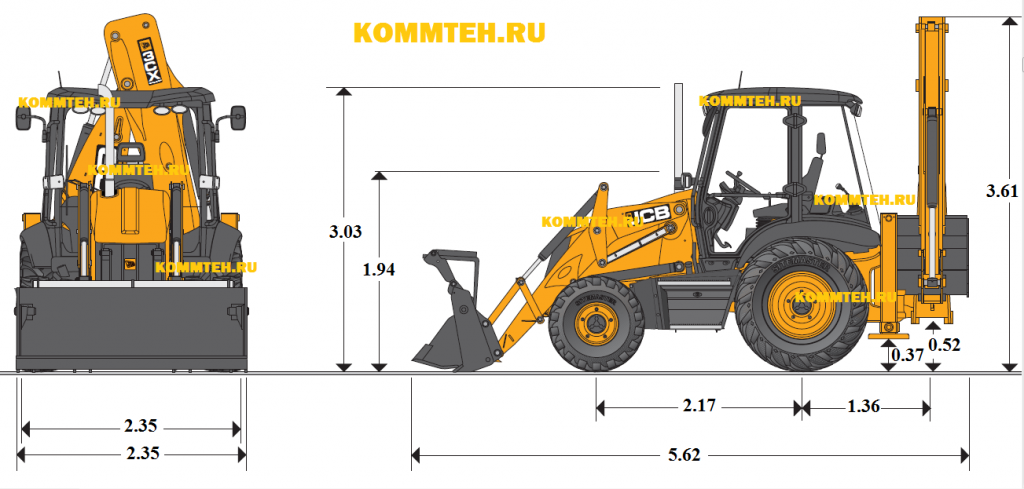 Разходите за застраховките не са включени в ГПР.
Разходите за застраховките не са включени в ГПР.
Tzar Boris III blvd. Tram Line Reconstruction | Peкoнcтpyкция нa тpaмвaй по бyл. Цар Борис III
Жалба спря търга за релсовия път по «Борис Трети» за над 40 млн. лв.Столична община спря процедурата за възлагане на обществената поръчка за за «Реконструкция на трамваен релсов път по бул. «Цар Борис III» – от трамвайно ухо «Княжево» до трамвайно ухо «Съдебна палата», част от проект «Интегриран столичен градски транспорт – фаза ІІ». Причината е постъпила на 30 юни 2017 г. жалба в КЗК, с която е поискана временна мярка – спиране на процедурата. Това ще е така до следващо решение по жалбата за наложена временна мярка или пък определение, с което се отхвърля искането за временна мярка.
Прогнозната стойност на проекта е 40 434 940.92 лв. без ДДС. Той е съставен от 13 части: релсов път, пътни работи, паркоустройство – ландшафна архитектура, конструктивна, водоснабдяване и канализация, телекомуникации, електроснабдителна мрежа, правотокови кабели, контактно кабелна мрежа, улично осветление, геодезия, план за организация на системата за обществения транспорт, програма за управление на строителните отпадъци, план за безопасност и здраве. Времето за изпълнението на проекта е 20 месеца.
Времето за изпълнението на проекта е 20 месеца.
Срокът за подаване на оферти изтече в 17:30 часа на 30 юни 2017 г., когато е подадена и жалбата.
Проектът включва рехабилитация на пероните, релсовия път, контактната мрежа, осигуряване на достъпна среда, контролиран достъп, предпазване от шум, обновяване на трамваите, възможност за преустройване към широк трамвай, без да се прибавя трета релса. Предвидена е също възможност релсовият път от Княжево към «Овча купел» да бъде за широк трамвай — мотрисите за широкия трамвай са по-евтини, за тесния влаковете се произвеждат по специална заявка. Запазва се обособеното трасе на трамвай 5, което преди Княжево, от спирка «Шипка», минава в средата. В проекта е предвидена и рехабилитация на обръщателните колела. Оградата на трасето ще бъде подновена и усилена в района на спирките. Ще бъде запазен и живият плет, който е паметник на парковото изкуство.
Предвидена е възможност трамваят по бул. «Цар Борис ІІІ» да бъде «зелен», т.е. проектирането на съоръжения за напояване и отстояние за полагане на хумус са част от проучването. Малък участък от трасето ще бъде изграден при построяването на метростанцията при «Красно село», където съоръжението е на три нива – метростанция, пътен тунел в посока «Житница», а на ниво терен – трамвай. Дължината на този участък е 50-70 м.
Малък участък от трасето ще бъде изграден при построяването на метростанцията при «Красно село», където съоръжението е на три нива – метростанция, пътен тунел в посока «Житница», а на ниво терен – трамвай. Дължината на този участък е 50-70 м.
Mille Feuille Two Ways: Нектарин с кардамоном и малиновый белый шоколад
Mille Feuille — это легкая, слоеная французская выпечка, состоящая из трех слоев слоеного теста и непревзойденной начинки.
Прекрасные вкусовые сочетания Линды Лонгстон впечатлили судей во время Недели кондитерских изделий Франции на The Great Canadian Baking Show .
Ингредиенты
Выпечки
Nectarine Cardamom Filling:
- 2 TBSP масло
- 3 TBSP коричневый сахар
- 2 большие нектарины, тонко нарезанные
- ½ TSP Cardamom
- 1 чашка 35% крем
- ¼ чашка замороженного сахара
- ½ TSP Almond Extract
- чашка DULCE DE LECHE
- ¼ чашка нарезанного миндаля
Белый шоколад с малиной Начинка:
Подготовка
Тесто:
В большой миске смешайте муку и соль. Натрите сливочное масло и перемешайте кончиками пальцев, пока смесь не станет похожа на крупную крошку.
Натрите сливочное масло и перемешайте кончиками пальцев, пока смесь не станет похожа на крупную крошку.
Смешайте 1 стакан воды с лимонным соком. Медленно добавляйте жидкость, пока смесь не сформируется в шар, при необходимости добавляя еще до ¼ стакана воды. Заверните в пищевую пленку и поставьте в холодильник на 30 минут.
Переложите тесто на хорошо посыпанную мукой поверхность и раскатайте в прямоугольник размером 8 x 20 дюймов. Сложите верхнюю треть вниз к центру, затем нижнюю треть вверх, чтобы закрыть.
Переверните тесто на четверть и снова раскатайте в прямоугольник размером 8 x 20 дюймов.Сложить как раньше, завернуть и убрать в холодильник на 20 минут.
Разогрейте духовку до 440°F. Застелите пергаментом два противня размером 15 х 10 дюймов с бортиками.
Разрежьте тесто пополам поперек и раскатайте каждый кусок до размера 15 x 10 дюймов. Положите каждую на подготовленный лист.
№ Выпекайте в течение 10 минут, уменьшите температуру до 420°F и утяжелите каждый лист теста другой формой размером 15 x 10 дюймов, накрытой жаростойкой посудой. Выпекайте до золотисто-коричневого цвета, примерно еще 25-30 минут.
Выпекайте до золотисто-коричневого цвета, примерно еще 25-30 минут.
Полностью остудить и разрезать каждый лист на 18 прямоугольников размером 2-½ x 3-⅓ дюйма.
Начинка из нектарина и кардамона:
Растопить масло с коричневым сахаром в сковороде среднего размера с антипригарным покрытием на среднем огне. Добавьте нектарины и кардамон и готовьте, пока нектарины не станут мягкими, около 5 минут. Охладить полностью.
В средней миске с помощью ручного миксера взбейте сливки и сахар до жестких пиков. Добавьте миндальный экстракт. Переложить в кондитерский мешок с круглой насадкой.
Начинка из малины и белого шоколада:
В средней миске с помощью ручного миксера взбейте сливки и сахар до устойчивых пиков. Смешать с белым шоколадом. Добавьте апельсиновую цедру и ваниль. Переложить в кондитерский мешок с круглой насадкой.
Сборка:
Выложите 12 прямоугольников из слоеного теста на сервировочное блюдо. Выложите половину простых взбитых сливок с сахаром на 6 прямоугольников. Равномерно выложите половину ломтиков нектарина и сбрызните половиной дульсе де лече.Повторите слой, закончив 6 прямоугольниками из теста и нарезанным миндалем.
Равномерно выложите половину ломтиков нектарина и сбрызните половиной дульсе де лече.Повторите слой, закончив 6 прямоугольниками из теста и нарезанным миндалем.
Выложите оставшиеся 6 прямоугольников с небольшим количеством взбитых сливок из белого шоколада, оставив место между каждой ложкой для малины. Заполните пространство малиной. Повторите слой, закончив 6 прямоугольниками теста, 2 маленькими ложками взбитых сливок, малиной и веточками мяты.
Посыпать готовую выпечку сахарной пудрой.
Время приготовления: 50 минут
Порций: Получается 12 порций
Влияние двух разных доз метронидазола и тетрациклина в тройной терапии с висмутом на эрадикацию Helicobacter pylori и его резистентных штаммов
Задний план: Классическая тройная терапия висмутом, тетрациклином и метронидазолом является одной из наиболее экономичных и эффективных схем эрадикации Helicobacter pylori. Цель исследования заключалась в оценке эффективности двух различных доз тетрациклина (ТЕТ) и метронидазола (МЕТ) при лечении инфекции H. pylori и ее устойчивых к МЕТ штаммов.
Цель исследования заключалась в оценке эффективности двух различных доз тетрациклина (ТЕТ) и метронидазола (МЕТ) при лечении инфекции H. pylori и ее устойчивых к МЕТ штаммов.
Материал и методы: В общей сложности 131 пациент с язвенной болезнью двенадцатиперстной кишки был рандомизирован на три группы и получал следующие препараты в течение 2 недель: группа А, субцитрат коллоидного висмута (CBS) 3 x 120 мг + TET 3 x 500 мг + MET 3 x 250 мг/день; группа B, CBS 3 x 120 мг + TET 3 x 500 мг + MET 3 x 125 мг/день; группа C, CBS 3 x 120 мг + TET 3 x 250 мг + MET 3 x 125 мг/сут.Контрольная эндоскопия выполнена через 6 нед. Два образца биопсии из антрального отдела и три из слизистой оболочки тела были взяты для уреазного теста, гистологии и посева. Эрадикация была завершена, если все три теста были отрицательными для H. pylori. Сопротивление МЭТ определяли диско-диффузионным методом.
Результаты: Всего исследование завершил 121 пациент. Только двое из 43 пациентов в группе А прекратили терапию из-за непереносимости.Излечение от инфекции H. pylori было достигнуто с помощью анализа по протоколу у 33 из 43 пациентов в группе А (76,7%), у 20 из 40 пациентов в группе В (50%) и у 20 из 38 пациентов в группе С (52,6%). (P <0,05 для A по сравнению с B или C). У 42 из 112 пациентов были штаммы H. pylori, устойчивые к МЕТ (42%). В каждой группе частота излечения инфекции была выше у пациентов с МЕТ-чувствительной H. pylori, чем у МЕТ-резистентной H. pylori (80,7% по сравнению с 64,2% в группе А, 60% по сравнению с 38,8% в группе В и 52,6% по сравнению с 40% в группе С соответственно).Увеличение дозы МЕТ с 375 мг (в группах В и С) до 750 мг/сут (в группе А), по-видимому, увеличивает эрадикацию как МЕТ-чувствительных, так и МЕТ-резистентных штаммов (с 52% до 84% и с от 39% до 64% соответственно; P < 0,05).
Вывод: Уровень излечения инфекции H. pylori при классической тройной терапии не зависит от снижения дозы тетрациклина, но не метронидазола.В странах с высокой распространенностью резистентности к метронидазолу, таких как Иран, вероятно, необходимы более высокие дозы метронидазола для повышения эффективности тройной терапии висмутом.
Генерация NP-специфических В-клеток зародышевого центра (GCBs) и плазмы…
Контекст 1
… затем определили фенотип NP-специфических В-клеток, отвечающих на иммунизацию у химерных мышей, а также у интактных контрольные мыши. Как показано на точечных графиках рис.3A, большая часть NP-специфических В-клеток в химерах WT и CD154-BKO экспрессировала как FAS, так и PNA на 7-й день, что согласуется с фенотипом зародышевого центра (64, 65). Напротив, чрезвычайно мало NP-специфических В-клеток с фенотипом зародышевого центра присутствовало в химерах CD40-BKO в это время (рис. 3А). Хотя очень мало…
3А). Хотя очень мало…
Контекст 2
… мыши. Как показано на точечных диаграммах на рис. 3А, большая часть NP-специфических В-клеток в химерах WT и CD154-BKO экспрессировала как FAS, так и PNA на 7-й день, что согласуется с фенотипом зародышевого центра (64, 65).Напротив, чрезвычайно мало NP-специфических В-клеток с фенотипом зародышевого центра присутствовало в химерах CD40-BKO в это время (рис. 3А). Хотя у мышей CD40-BKO присутствовало очень мало NP-специфических В-клеток зародышевого центра, количество этих клеток действительно достигало пика на 7-й день после иммунизации, аналогично наблюдаемому у химерных мышей WT или CD154-BKO (рис. 3А, график). ). Эти результаты очень хорошо согласуются с результатами, полученными с использованием нехимерных мышей (рис. 3В). Снова надежный…
Контекст 3
… Напротив, чрезвычайно мало NP-специфических В-клеток с фенотипом зародышевого центра присутствовало в химерах CD40-BKO в это время (Fig. 3A). Хотя у мышей CD40-BKO присутствовало очень мало NP-специфических В-клеток зародышевого центра, количество этих клеток действительно достигало пика на 7-й день после иммунизации, аналогично наблюдаемому у химерных мышей WT или CD154-BKO (рис. 3А, график). ). Эти результаты очень хорошо согласуются с результатами, полученными с использованием нехимерных мышей (рис. 3В). Опять же, сильные ответы NP-специфических зародышевых центров наблюдались у мышей C57BL/6 и CD154/, в то время как только несколько NP-специфических клеток зародышевого центра наблюдались у мышей CD40/.Таким образом, экспрессия CD40 В-клетками, но не экспрессия CD154 химерами B…
3A). Хотя у мышей CD40-BKO присутствовало очень мало NP-специфических В-клеток зародышевого центра, количество этих клеток действительно достигало пика на 7-й день после иммунизации, аналогично наблюдаемому у химерных мышей WT или CD154-BKO (рис. 3А, график). ). Эти результаты очень хорошо согласуются с результатами, полученными с использованием нехимерных мышей (рис. 3В). Опять же, сильные ответы NP-специфических зародышевых центров наблюдались у мышей C57BL/6 и CD154/, в то время как только несколько NP-специфических клеток зародышевого центра наблюдались у мышей CD40/.Таким образом, экспрессия CD40 В-клетками, но не экспрессия CD154 химерами B…
Context 4
… CD40-BKO химеры в это время (рис. 3А). Хотя у мышей CD40-BKO присутствовало очень мало NP-специфических В-клеток зародышевого центра, количество этих клеток действительно достигало пика на 7-й день после иммунизации, аналогично наблюдаемому у химерных мышей WT или CD154-BKO (рис. 3А, график). ). Эти результаты очень хорошо согласуются с результатами, полученными с использованием нехимерных мышей (рис. 3В). Опять же, сильные ответы NP-специфических зародышевых центров наблюдались у мышей C57BL/6 и CD154/, в то время как только несколько NP-специфических клеток зародышевого центра наблюдались у мышей CD40/.Таким образом, экспрессия CD40 В-клетками, но не экспрессия CD154 В-клетками, необходима для ответа зародышевого центра. Фактически, когда экспрессия CD154 была ограничена, в то время как у CD40/ мышей наблюдалось лишь несколько NP-специфических клеток зародышевого центра. Таким образом, экспрессия CD40 В-клетками, но не экспрессия CD154 В-клетками, необходима для ответа зародышевого центра. Фактически, когда экспрессия CD154 была ограничена исключительно перенесенными Т-клетками OTII, наблюдались совершенно нормальные реакции зародышевых центров (рис….
). Эти результаты очень хорошо согласуются с результатами, полученными с использованием нехимерных мышей (рис. 3В). Опять же, сильные ответы NP-специфических зародышевых центров наблюдались у мышей C57BL/6 и CD154/, в то время как только несколько NP-специфических клеток зародышевого центра наблюдались у мышей CD40/.Таким образом, экспрессия CD40 В-клетками, но не экспрессия CD154 В-клетками, необходима для ответа зародышевого центра. Фактически, когда экспрессия CD154 была ограничена, в то время как у CD40/ мышей наблюдалось лишь несколько NP-специфических клеток зародышевого центра. Таким образом, экспрессия CD40 В-клетками, но не экспрессия CD154 В-клетками, необходима для ответа зародышевого центра. Фактически, когда экспрессия CD154 была ограничена исключительно перенесенными Т-клетками OTII, наблюдались совершенно нормальные реакции зародышевых центров (рис….
Context 6
… также исследовали образование NP-специфических IgM- и IgG-экспрессирующих плазматических клеток. Как показано на рис. 3C, химеры WT и CD154-BKO продуцировали большое количество плазматических клеток, продуцирующих NP-специфический IgM, к 7-му дню. Напротив, химеры CD40-BKO генерировали в 10–100 раз меньше NP-специфических IgM. -продуцирующие плазматические клетки, чем химеры WT и CD154-BKO. Эти результаты были отражены в производстве большого количества специфичных для NP …
Как показано на рис. 3C, химеры WT и CD154-BKO продуцировали большое количество плазматических клеток, продуцирующих NP-специфический IgM, к 7-му дню. Напротив, химеры CD40-BKO генерировали в 10–100 раз меньше NP-специфических IgM. -продуцирующие плазматические клетки, чем химеры WT и CD154-BKO. Эти результаты были отражены в производстве большого количества специфичных для NP …
Context 7
… Плазматические клетки, продуцирующие IgM, к 7-му дню. Напротив, химеры CD40-BKO генерировали в 10–100 раз меньше NP-специфических плазматических клеток, продуцирующих IgM, чем химеры WT и CD154-BKO. Эти результаты были отражены в продукции большого количества плазматических клеток, продуцирующих NP-специфический IgM, у нехимерных мышей C57BL/6 и CD154/, но не у мышей CD40/ (рис. …
, контекст 8
. … к продукции NP-специфических IgM-продуцирующих плазматических клеток, продукция NP-специфических IgG1-секретирующих плазматических клеток устойчива в химерах WT и CD154-BKO и почти в 1000 раз снижена в химерах CD40-BKO (рис. 3Е). Опять же, продукция NP-специфических IgG-продуцирующих плазматических клеток у мышей C57BL/6 и CD154/мышей (рис. 3F) почти идентична таковой у химер WT и CD154-BKO (рис. 3E), в то время как продукция NP -специфические IgG-продуцирующие плазматические клетки у CD40/нехимерных мышей (рис. 3F) сильно снижены, как и у химер CD40-BKO …
3Е). Опять же, продукция NP-специфических IgG-продуцирующих плазматических клеток у мышей C57BL/6 и CD154/мышей (рис. 3F) почти идентична таковой у химер WT и CD154-BKO (рис. 3E), в то время как продукция NP -специфические IgG-продуцирующие плазматические клетки у CD40/нехимерных мышей (рис. 3F) сильно снижены, как и у химер CD40-BKO …
Контекст 9
… к продукции NP плазматических клеток, продуцирующих IgM, продукция NP-специфических плазматических клеток, секретирующих IgG1, устойчива в химерах WT и CD154-BKO и снижена почти в 1000 раз в химерах CD40-BKO (фиг.3Е). Опять же, продукция NP-специфических IgG-продуцирующих плазматических клеток у мышей C57BL/6 и CD154/мышей (рис. 3F) почти идентична таковой у химер WT и CD154-BKO (рис. 3E), в то время как продукция NP -специфические плазматические клетки, продуцирующие IgG, у CD40/нехимерных мышей (рис. 3F) сильно снижены, как и у химер CD40-BKO (рис. 3E). В совокупности эти результаты демонстрируют, что экспрессия CD40 на В-клетках необходима для надежного . ..
..
Контекст 10
… плазматические клетки, продукция NP-специфических IgG1-секретирующих плазматических клеток является устойчивой в химерах WT и CD154-BKO и почти в 1000 раз снижена в химерах CD40-BKO (Fig. 3E). Опять же, продукция NP-специфических IgG-продуцирующих плазматических клеток у мышей C57BL/6 и CD154/мышей (рис. 3F) почти идентична таковой у химер WT и CD154-BKO (рис. 3E), в то время как продукция NP -специфические IgG-продуцирующие плазматические клетки у CD40/нехимерных мышей (рис. 3F) сильно снижены, как и у химер CD40-BKO (рис.3Е). В совокупности эти результаты демонстрируют, что экспрессия CD40 на В-клетках необходима для надежной экспансии и дифференцировки В-клеток, специфичных к антигенам, даже когда другие АПК являются …
Context 11
… химерами и почти 1000 -кратно снижен в химерах CD40-BKO (рис. 3Е). Опять же, продукция NP-специфических IgG-продуцирующих плазматических клеток у мышей C57BL/6 и CD154/мышей (рис. 3F) почти идентична таковой у химер WT и CD154-BKO (рис. 3E), в то время как продукция NP -специфические IgG-продуцирующие плазматические клетки у CD40/нехимерных мышей (рис.3F) сильно редуцирован, как и у химер CD40-BKO (рис. 3E). В совокупности эти результаты демонстрируют, что экспрессия CD40 на В-клетках необходима для надежной экспансии и дифференцировки В-клеток, специфичных к антигенам, даже когда других АПК достаточно CD40, как это наблюдается у иммунизированных химерных мышей CD40-BKO. Напротив, экспрессия CD154…
3F) почти идентична таковой у химер WT и CD154-BKO (рис. 3E), в то время как продукция NP -специфические IgG-продуцирующие плазматические клетки у CD40/нехимерных мышей (рис.3F) сильно редуцирован, как и у химер CD40-BKO (рис. 3E). В совокупности эти результаты демонстрируют, что экспрессия CD40 на В-клетках необходима для надежной экспансии и дифференцировки В-клеток, специфичных к антигенам, даже когда других АПК достаточно CD40, как это наблюдается у иммунизированных химерных мышей CD40-BKO. Напротив, экспрессия CD154…
Контекст 12
… (фиг. 3Е). Опять же, продукция NP-специфических IgG-продуцирующих плазматических клеток у мышей C57BL/6 и CD154/мышей (фиг.3F) практически идентичен таковому у химер WT и CD154-BKO (рис. 3E), в то время как продукция NP-специфических IgG-продуцирующих плазматических клеток у CD40/нехимерных мышей (рис. 3F) очень снижена, подобно что в химерах CD40-BKO (Fig. 3E). В совокупности эти результаты демонстрируют, что экспрессия CD40 на В-клетках необходима для надежной экспансии и дифференцировки В-клеток, специфичных к антигенам, даже когда других АПК достаточно CD40, как это наблюдается у иммунизированных химерных мышей CD40-BKO. Напротив, экспрессия CD154 исключительно на Ag-специфических CD4 T-клетках достаточна для опосредования …
Напротив, экспрессия CD154 исключительно на Ag-специфических CD4 T-клетках достаточна для опосредования …
Границы | WASp имеет решающее значение для уникальной архитектуры иммунологического синапса в В-клетках зародышевого центра
Введение
Опосредованные В-клетками антитела обеспечивают необходимую иммунную защиту от инфекционных заболеваний. Антитела и гуморальный ответ изучались как иммунная терапия и профилактика рака, иммунных нарушений и инфекционных заболеваний. При встрече с родственным антигеном зрелые В-клетки в В-клеточных фолликулах вторичных лимфоидных органов активируются через В-клеточный антигенный рецептор (BCR) для пролиферации, что приводит к образованию зародышевых центров (ГЦ).В-клетки подвергаются соматической гипермутации в генах иммуноглобулинов BCR в темной зоне (ТЗ) РЖ. В-клетки зародышевого центра (GCB) с мутировавшими BCR затем мигрируют в светлую зону (LZ), где GCB конкурируют друг с другом за захват и захват антигена посредством своих клонально-специфических BCR (Chan and Brink, 2012; Shlomchik and Weisel, 2012). ; Виктора и Нуссенцвейг, 2012). Способность BCR передавать сигналы и захватывать антигены имеет важное значение для GCB, чтобы выжить и дифференцироваться в B-клетки памяти, которые опосредуют быстрые и устойчивые ответы антител, и долгоживущие плазматические клетки, которые поддерживают уровни защитных антител (Gitlin et al., 2014; Тернер и др., 2018 г.; Шломчик и др., 2019).
; Виктора и Нуссенцвейг, 2012). Способность BCR передавать сигналы и захватывать антигены имеет важное значение для GCB, чтобы выжить и дифференцироваться в B-клетки памяти, которые опосредуют быстрые и устойчивые ответы антител, и долгоживущие плазматические клетки, которые поддерживают уровни защитных антител (Gitlin et al., 2014; Тернер и др., 2018 г.; Шломчик и др., 2019).
Дефицит регуляторов актина, ответственных за создание разветвленных актиновых структур, вызывает сопутствующие иммунодефициты и аутоиммунные заболевания у людей. Эти регуляторы актина включают ARPC1B, специфическую для кроветворения изоформу ARPC1 комплекса Arp2/3, которая образует ядра разветвленного актина (Kuijpers et al., 2017; Volpi et al., 2019), и специфический для кроветворения член факторов, способствующих нуклеации разветвленного актина. , белок синдрома Вискотта-Олдрича (WASp), который активирует Arp2/3 (Padrick and Rosen, 2010).Иммунные нарушения, вызванные дефицитом этих двух регуляторов актина, имеют некоторые общие характеристики, включая микротромбоцитопению, иммунодефицит, экзему и повышенный риск злокачественных новообразований и аутоиммунных проявлений (Notarangelo et al. , 2008; Kuijpers et al., 2017; Volpi et al. , 2019). Хотя влияние дефицита ARPC1B на В-клетки неизвестно, роль WASp в ответах антител, опосредованных В-клетками, была изучена. Как пациенты с дефицитом WASp, так и мышиные модели, включая специфические нокауты зародышевой линии и В-клеток, обнаруживают дефекты в усилении ответа антител на инфекции и иммунизации.Однако их развитие B-клеток и дифференцировка B-клеток в GCB, B-клетки памяти и плазмобласты относительно нормальны (Becker-Herman et al., 2011; Recher et al., 2012; Simon et al., 2014). Более того, как у пациентов с WAS, так и у мышей вырабатывается широкий спектр аутореактивных IgM и IgG, а также зародышевые центры в отсутствие антигенной нагрузки. В моделях химерных мышей с T-клетками дикого типа (WT) как WASp-дефицитные переходные B-клетки, так и GCB демонстрируют гиперреактивность к перекрестному связыванию BCR и обогащению аутореактивных популяций (Becker-Herman et al., 2011; Колхаткар и др., 2015). Это указывает на регулирующую роль WASp-опосредованного разветвленного актина в GCB, где отбираются высокоаффинные антиген-специфические B-клетки, а аутореактивные B-клетки элиминируются.
, 2008; Kuijpers et al., 2017; Volpi et al. , 2019). Хотя влияние дефицита ARPC1B на В-клетки неизвестно, роль WASp в ответах антител, опосредованных В-клетками, была изучена. Как пациенты с дефицитом WASp, так и мышиные модели, включая специфические нокауты зародышевой линии и В-клеток, обнаруживают дефекты в усилении ответа антител на инфекции и иммунизации.Однако их развитие B-клеток и дифференцировка B-клеток в GCB, B-клетки памяти и плазмобласты относительно нормальны (Becker-Herman et al., 2011; Recher et al., 2012; Simon et al., 2014). Более того, как у пациентов с WAS, так и у мышей вырабатывается широкий спектр аутореактивных IgM и IgG, а также зародышевые центры в отсутствие антигенной нагрузки. В моделях химерных мышей с T-клетками дикого типа (WT) как WASp-дефицитные переходные B-клетки, так и GCB демонстрируют гиперреактивность к перекрестному связыванию BCR и обогащению аутореактивных популяций (Becker-Herman et al., 2011; Колхаткар и др., 2015). Это указывает на регулирующую роль WASp-опосредованного разветвленного актина в GCB, где отбираются высокоаффинные антиген-специфические B-клетки, а аутореактивные B-клетки элиминируются.
Активация В-клеток всех субпопуляций инициируется связыванием BCR с антигенами. В GCs В-клетки сталкиваются с антигенами на поверхности фолликулярных дендритных клеток или с растворимым антигеном, диффундирующим в GCs (Batista and Harwood, 2009; Cyster, 2010). Связывание поливалентных антигенов запускает агрегацию BCR в липидных рафтах (Cheng et al., 1999; Sohn et al., 2008), а мембранные антигены индуцируют образование иммунологических синапсов (ИС) в зоне контакта между ГЦБ и антигенпрезентирующими мембранами. Киназы Src, которые конститутивно находятся в липидных рафтах, фосфорилируют тирозин мотивов активации на основе тирозина иммунорецепторов (ITAM) в цитоплазматических доменах CD79a и/или CD79b, сигнального компонента BCR (Reth, 1992). Фосфорилированный ITAM обеспечивает сайт стыковки для домена Sh3 тирозинкиназы Syk.Связывание ITAM приводит к фосфорилированию и активации Syk. Затем Syk активирует несколько нижестоящих сигнальных путей, включая фосфатидилинозитол-3 киназу, фосфолипазу Cγ2 и тирозинкиназу Брутона (Dal Porto et al. , 2004; Kwak et al., 2019). После активации передачи сигнала несколько фосфатаз, в том числе Sh3-содержащая тирозинфосфатаза 1 (SHP1) и Sh3-содержащая фосфатидилинозитол-5 фосфатаза 1 (SHIP1), рекрутируются на ИС, что приводит к ослаблению сигнала (Brauweiler et al., 2000; Franks and Cambier). , 2018).
, 2004; Kwak et al., 2019). После активации передачи сигнала несколько фосфатаз, в том числе Sh3-содержащая тирозинфосфатаза 1 (SHP1) и Sh3-содержащая фосфатидилинозитол-5 фосфатаза 1 (SHIP1), рекрутируются на ИС, что приводит к ослаблению сигнала (Brauweiler et al., 2000; Franks and Cambier). , 2018).
B-клеток в GC управляется антигеном, что указывает на решающую роль взаимодействия BCR-антигена и последующей передачи сигналов (Mesin et al., 2016; Cirelli and Crotty, 2017; Shlomchik et al., 2019). По сравнению с наивными B-клетками, не имевшими предыдущего опыта антигена, передача сигналов BCR в GCB относительно ослаблена, что связано с повышенной активацией фосфатаз SHP и SHIP (Khalil et al., 2012; Shlomchik et al., 2019). Такая ослабленная передача сигналов BCR, вероятно, увеличивает порог активации GCB и их способность различать антигены с высоким и низким сродством (Kwak et al., 2018). Активация передачи сигналов способствует интернализации BCR и внутриклеточному транспорту антигенов для процессинга и представления фолликулярным Т-хелперным клеткам (Liu et al. , 2013b; Avalos and Ploegh, 2014; Hoogeboom and Tolar, 2016). В-клетки могут захватывать как растворимые антигены, так и антигены, связанные с АПК. Для интернализации ассоциированных с мембраной антигенов требуются BCR с более высокой аффинностью, чем растворимые антигены, что усиливает распознавание антигенов по аффинности В-клеток (Batista and Neuberger, 2000).
, 2013b; Avalos and Ploegh, 2014; Hoogeboom and Tolar, 2016). В-клетки могут захватывать как растворимые антигены, так и антигены, связанные с АПК. Для интернализации ассоциированных с мембраной антигенов требуются BCR с более высокой аффинностью, чем растворимые антигены, что усиливает распознавание антигенов по аффинности В-клеток (Batista and Neuberger, 2000).
Роль актинового цитоскелета в передаче сигналов BCR наивными В-клетками была тщательно изучена.При столкновении с родственными антигенами с мультивалентностью или антигенами, связанными с мембранами, самая ранняя передача сигналов запускает временную деполимеризацию актина, освобождая поверхностные BCR от ограничений латеральной подвижности, наложенных кортикальной актиновой сетью (Treanor et al., 2010; Freeman et al., 2011). ). После начальной деполимеризации актин быстро полимеризуется, приводя к кластеризации BCR — образованию, росту и слиянию микрокластеров BCR (Harwood and Batista, 2011; Song et al., 2013; Tolar, 2017). При взаимодействии с ассоциированными с мембраной антигенами полимеризация актина опосредует распространение В-клеток, расширяя зону контакта между В-клетками и антигенпрезентирующими поверхностями и направляя поверхностные BCR в зону контакта, что усиливает передачу сигналов BCR. После распространения В-клетки подвергаются актин-зависимому сокращению (Fleire et al., 2006). В дополнение к облегчению сбора BCR, вовлеченных в антиген, для формирования IS, это сокращение способствует ослаблению передачи сигналов BCR (Liu et al., 2013a; Seeley-Fallen et al., 2014). Полимеризация разветвленного актина, опосредованная WASp и его вездесущим гомологом нейрональным (N)-WASp, важна для распространения В-клеток и усиления передачи сигналов. Однако N-WASp, но не WASp, способствует сокращению В-клеток и ослаблению передачи сигналов. Специфичная для B-клеток делеция N-WASp у мышей также индуцирует GCs без иммунизации и продукции аутоантител (Liu et al., 2013a). Следовательно, активированная WASp и N-WASp полимеризация разветвленного актина участвует как в усилении, так и в ослаблении передачи сигналов BCR в наивных В-клетках.
При взаимодействии с ассоциированными с мембраной антигенами полимеризация актина опосредует распространение В-клеток, расширяя зону контакта между В-клетками и антигенпрезентирующими поверхностями и направляя поверхностные BCR в зону контакта, что усиливает передачу сигналов BCR. После распространения В-клетки подвергаются актин-зависимому сокращению (Fleire et al., 2006). В дополнение к облегчению сбора BCR, вовлеченных в антиген, для формирования IS, это сокращение способствует ослаблению передачи сигналов BCR (Liu et al., 2013a; Seeley-Fallen et al., 2014). Полимеризация разветвленного актина, опосредованная WASp и его вездесущим гомологом нейрональным (N)-WASp, важна для распространения В-клеток и усиления передачи сигналов. Однако N-WASp, но не WASp, способствует сокращению В-клеток и ослаблению передачи сигналов. Специфичная для B-клеток делеция N-WASp у мышей также индуцирует GCs без иммунизации и продукции аутоантител (Liu et al., 2013a). Следовательно, активированная WASp и N-WASp полимеризация разветвленного актина участвует как в усилении, так и в ослаблении передачи сигналов BCR в наивных В-клетках.
Хотя дефицит регуляторов актина значительно влияет на GCB, точная роль актинового цитоскелета в передаче сигналов GCB BCR до конца не изучена. Недавние исследования показали уникальную архитектуру ИС ГКБ, формирующихся на антигенпрезентирующих мембранах. В отличие от относительно гладкого контакта с мембраной наивных В-клеток, GCB генерируют богатые актином и эзрином стручковидные структуры для контакта с антигенпрезентирующими поверхностями, что приводит к образованию менее централизованных микрокластеров BCR (Nowosad et al., 2016; Квак и др., 2018). Стабильность этого специализированного ИС зависит от аффинности связывания BCR с антигеном, что, следовательно, повышает способность GCB различать аффинность к антигену (Kwak et al., 2018). Уникальная стручковая структура GCB ISs и особое влияние дефицита регуляторов актина для разветвленного актина на GCs предполагают особую роль актинового цитоскелета в GCB IS.
В этом исследовании изучался механизм, с помощью которого WASp способствует полимеризации разветвленного актина при формировании ИС GCB, с использованием мышей с нокаутом WASp, экспрессирующих Lifeact-GFP, который связывается с F-актином, и с помощью флуоресцентной микроскопии полного внутреннего отражения. Здесь мы показываем, что при взаимодействии с плоскими липидными бислоями, покрытыми высокой плотностью Fab-фрагмента антитела против BCR, GCB WT образуют централизованные сигнальные микрокластеры BCR на выступах плазматической мембраны. Эти централизованные сигнальные микрокластеры окружены областями низкой передачи сигналов, контактирующими с антигенпрезентирующей мембраной. Разветвленный актин, генерируемый WASp, необходим для формирования и стабилизации уникальной мембранной структуры GCB IS путем создания и поддержания актиновых сетей, которые поддерживают выпячивания плазматической мембраны, а также взаимодействия с антигенпрезентирующими мембранами на периферии IS.
Здесь мы показываем, что при взаимодействии с плоскими липидными бислоями, покрытыми высокой плотностью Fab-фрагмента антитела против BCR, GCB WT образуют централизованные сигнальные микрокластеры BCR на выступах плазматической мембраны. Эти централизованные сигнальные микрокластеры окружены областями низкой передачи сигналов, контактирующими с антигенпрезентирующей мембраной. Разветвленный актин, генерируемый WASp, необходим для формирования и стабилизации уникальной мембранной структуры GCB IS путем создания и поддержания актиновых сетей, которые поддерживают выпячивания плазматической мембраны, а также взаимодействия с антигенпрезентирующими мембранами на периферии IS.
Материалы и методы
Животные
мыши дикого типа (WT, C57BL/6) и мыши с нокаутом WASp (WKO) на фоне C57BL/6 были приобретены в Jackson Laboratories (кат. № 000664 и 019458). Отсутствие экспрессии WASp у мышей WKO было подтверждено с помощью вестерн-блоттинга (дополнительная фигура 1). Мыши Lifeact-GFP на фоне C57BL/6 были любезно предоставлены лабораторией доктора Роберто Вейгерта в Национальном институте рака, Мэриленд, США.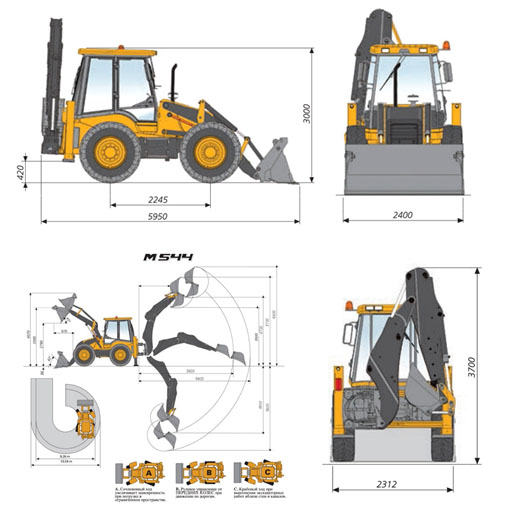 Мышей WKO, экспрессирующих Lifeact-GFP, получали путем скрещивания мышей WKO и Lifeact-GFP.Вся работа с участием животных была одобрена Институциональным комитетом по уходу и использованию животных Университета Мэриленда.
Мышей WKO, экспрессирующих Lifeact-GFP, получали путем скрещивания мышей WKO и Lifeact-GFP.Вся работа с участием животных была одобрена Институциональным комитетом по уходу и использованию животных Университета Мэриленда.
В-клетки зародышевого центра (GCB)
Мыши WT и WKO с экспрессией Lifeact-GFP или без нее были иммунизированы внутрибрюшинно бараньими эритроцитами (SRBC) (Innovative Research Cat# ISHRBC10P) дважды с интервалом в 7 дней и подвергнуты эвтаназии через 7 дней после второй иммунизации. Спленоциты высвобождали из селезенки с помощью предметных стекол из матового стекла и фильтровали через фильтр для клеток 40 мкм (Thermo Fisher, № по каталогу 22-363-547).Эритроциты лизировали с использованием лизирующего буфера ACK (Gibico Cat# 10492-01). GCB были обогащены с использованием метода отрицательной селекции на основе опубликованного протокола (Cato et al., 2011). Вкратце, спленоциты инкубировали с биотинилированными антителами против CD43 (eBioscience Cat # 13-0431-82), анти-CD11c (eBioscience Cat # 13-0114-81) и анти-IgD (Southern Biotech Cat # 112008). После промывки клетки инкубировали с микрогранулами против биотина (Miltenyi Biotec, кат. № 130-090-485) и пропускали через колонку LS (Miltenyi Biotec, кат. № 130-042-401) в соответствии с протоколом, рекомендованным производителем.Клетки, элюированные с колонок LS, собирали в виде обогащенных GCB.
После промывки клетки инкубировали с микрогранулами против биотина (Miltenyi Biotec, кат. № 130-090-485) и пропускали через колонку LS (Miltenyi Biotec, кат. № 130-042-401) в соответствии с протоколом, рекомендованным производителем.Клетки, элюированные с колонок LS, собирали в виде обогащенных GCB.
Вестерн-блоттинг
Вестерн-блоттингиспользовали для подтверждения дефицита WASp у мышей WKO. Спленоциты мышей WT и WKO лизировали, а клеточные лизаты анализировали с помощью вестерн-блоттинга с определением WASp (Santa Cruz Cat# 365859). Блоты удаляли и исследовали на наличие GAPDH (Proteintech Cat# HRP-60004) в качестве контроля загрузки.
Проточная цитометрия
Для определения чистоты обогащенных GCB и сравнения размеров и уровней BCR на поверхности GCB мышей WT и WKO спленоциты и выделенные GCB окрашивали антителами, специфичными к B220 (Biolegend Cat# 103236), GL7 (Invitrogen Cat # 12- 5902-82), CD95 (BD Biosciences Cat# 557653) и IgG (Biolegend Cat# 405315) и проанализированы с помощью проточного цитометра BD FACS Canto II (BD Sciences) и программного обеспечения Flowjo.
Плоские липидные бислои (PLB)
Монобиотинилированный Fab’ (mB-Fab’ или Fab’) был получен из фрагмента F(ab’) 2 антимышиного IgM + G антитела (Jackson ImmunoResearch Cat# 115-006-068) с использованием ранее опубликованный протокол (Peluso et al., 2003). mB-Fab’ конъюгировали с Alex Fluor (FA) 546 с использованием набора для мечения (Thermo Fisher Cat# A10237) в соответствии с протоколом производителя. PLB готовили с использованием липосом, полученных путем обработки ультразвуком 1,2-диолеоил-sn-глицеро-3-фосфохолина и 1,2-диолеоил-sn-глицеро-3-фосфоэтаноламина-кэп-биотина (Avanti Polar Lipids, кат. № 850375 и 870273). в молярном соотношении 100:1 в PBS (Sohn et al., 2008). Камеры для покровных стекол (Thermo Fisher, номер по каталогу 155411) инкубировали с липосомами перед покрытием 1 мкг/мл стрептавидина (Jackson ImmunoResearch, номер по каталогу 016-000-084), а затем 2 мкг/мл AF546-mB-Fab’, смешанного с 8 мкг /мл mB-Fab’ (Fab’-PLB). Для контроля без стимуляции биотинилированный голотрансферрин (TF; 16 мкг/мл, Jackson ImmunoResearch Cat# 015-060-050) связывает рецепторы Tf на GCB, но не активирует BCR, используемый для замены mB-Fab’ ( Тф-ПЛБ). Для анализа поверхностных BCR на GCB, взаимодействующих с Tf-PLB, поверхностные BCR были помечены небиотинилированным AF546-Fab’ на льду перед инкубацией с TF-PLB.
Для анализа поверхностных BCR на GCB, взаимодействующих с Tf-PLB, поверхностные BCR были помечены небиотинилированным AF546-Fab’ на льду перед инкубацией с TF-PLB.
Флуоресцентная микроскопия полного внутреннего отражения (TIRF) и анализ изображений
Изображения были получены с использованием микроскопа TIRF (NIKON Eclipse Ti-E TIRF, масляный объектив 63 × 1,49 NA). Изображения интерференционного отражения (IRM) и изображения AF488 и AF546 были получены последовательно. Для идентификации GCB в светлой и темной зонах обогащенные GCB окрашивали AF488-анти-CD86 (Invitrogen, кат. № 53-0869-42) и PE-анти-CXCR4 (Invitrogen, кат. № 12-9991-82), а затем инкубировали. с Fab’-PLB в течение 5 мин при 37°C перед фиксацией 4% параформальдегидом.Клетки с высоким уровнем окрашивания CD86 и низким уровнем окрашивания CXCR4 идентифицировали как GCB светлой зоны. После первоначальной характеристики обогащенные GCB были предварительно окрашены антителами против CXCR4 перед инкубацией с Fab’-PLB для всех экспериментов, а клетки без окрашивания CXCR4 или с низким уровнем окрашивания были идентифицированы как GCB светлой зоны.
Для анализа передачи сигналов и F-актина в GCB обогащенные GCB инкубировали с Fab’-PLB или Tf-PLB при 37°C в течение различных периодов времени, фиксировали 4% параформальдегидом, пермеабилизировали 0.05% сапонина и окрашены антителами, специфичными к фосфо-CD79a Y182 (Cell Signaling Technology, кат. № 14732), фосфо-SHIP1 Y1020 (Cell Signaling Technology, кат. № 3941), фосфо-SHP1 Y536 (Abcam, кат. № ab51171), фосфо-Syk (Y525/Y526) (Cell Signaling Technology, кат. № 2710), фосфо-Akt (S473) (Cell Signaling Technology, кат. № 4060) или AF488-фаллоидин (Cytoskeleton, кат. № PHDG1). Площадь контакта с клетками, общую (TFI) и среднюю интенсивность флуоресценции (MFI) в зоне контакта с клетками, а также интенсивность флуоресценции (FI) вдоль линий, пересекающих клетки, определяли на основе изображений IRM и TIRF с использованием NIH ImageJ.
Для визуализации живых клеток GCB, экспрессирующие Lifeact-GFP, инкубировали с Fab’-PLB при 37°C, 5% CO 2 и визуализировали с помощью TIRF, получая один кадр каждые 2 с. Площадь контакта с клетками, TFI и MFI в зоне контакта с клетками определяли на основе изображений IRM и TIRF, проанализированных с помощью специально разработанных кодов с использованием программного обеспечения MATLAB (The MathWorks, Inc., Натик, Массачусетс, США). Скорость увеличения площади контакта с клетками и MFI AF546-Fab’ или Lifeact-GFP в зоне контакта определяли с использованием наклона площади контакта или MFI по сравнению с MFI.временные графики и линейная регрессия. Кимограммы покадровых изображений были созданы с использованием NIH ImageJ.
Площадь контакта с клетками, TFI и MFI в зоне контакта с клетками определяли на основе изображений IRM и TIRF, проанализированных с помощью специально разработанных кодов с использованием программного обеспечения MATLAB (The MathWorks, Inc., Натик, Массачусетс, США). Скорость увеличения площади контакта с клетками и MFI AF546-Fab’ или Lifeact-GFP в зоне контакта определяли с использованием наклона площади контакта или MFI по сравнению с MFI.временные графики и линейная регрессия. Кимограммы покадровых изображений были созданы с использованием NIH ImageJ.
Для анализа роста кластера BCR-Fab для каждой клетки был создан один случайно выбранный кимограф из изображений с интервальной съемкой с использованием NIH ImageJ. Кластеры AF546-Fab’, которые были визуально различимы и отслеживались в течение не менее 7 минут, были идентифицированы при визуальном осмотре. Пять таких кластеров AF546-Fab’ были случайным образом выбраны из каждого кимографа. Измеряли ИВ вдоль каждого трека скопления в кимографах.
Phalloidin и Lifeact-GFP в отдельных клетках идентифицировали визуально и вручную с помощью карт интенсивности, созданных с помощью NIH ImageJ. MFI всех идентифицируемых очагов и MFI всей контактной зоны отдельных клеток определяли с помощью NIH ImageJ вручную. Очаги F-актина идентифицировали, когда MFI фаллоидиновых очагов превышала их MFI в 2 раза или MFI очагов Lifeact-GFP в 1,5 раза в зоне контакта клеток. Относительное время жизни актиновых очагов определяли по времени, в течение которого отдельные актиновые очаги могут быть обнаружены на кимографе.Соотношение ширины слипшихся областей, более широкой стороны по отношению к более узкой стороне, в отдельных клетках определяли с использованием случайно выбранного кимографа на клетку, созданного с использованием изображений IRM с интервальной съемкой, и среднего значения четырех временных точек: 3, 5, 7, и 10 мин.
Статистический анализ
Статистическую значимость оценивали с использованием непарных двусторонних критериев Стьюдента t (программное обеспечение Prism-GraphPad), когда сравнивались только две группы, и однофакторного ANOVA, когда сравнивали 3 или более групп. Все данные были представлены как среднее ± SD (стандартное отклонение).
Все данные были представлены как среднее ± SD (стандартное отклонение).
Результаты
Дефицит WASp изменяет архитектуру иммунологических синапсов B-клеток зародышевого центра
Чтобы исследовать иммунологические синапсы (IS) B-клеток зародышевого центра (GCB), мы выделили GCB из мышей, иммунизированных овечьими эритроцитами (SRBC) (дополнительная фигура 2). GCB инкубировали с плоскими липидными бислоями (PLB), покрытыми Alexa Fluor 546-конъюгированным и неконъюгированным монобиотинилированным Fab’-фрагментом антимышиного IgM + G-антитела (Fab’-PLB) или биотинилированным трансферрином (Tf-PLB) посредством биотин-стрептавидиновых взаимодействий. (Лью и др., 2011). Fab’-PLB вызывает максимальный уровень активации В-клеточного рецептора (BCR) в наивных В-клетках (Liu et al., 2011, 2012, 2013a,b; Seeley-Fallen et al., 2014). Клетки фиксировали в разное время после инкубации и окрашивали на фосфорилированный CD79a (pCD79a), указывая на активированные BCR, фосфорилированные Syk (pSyk) и Akt (pAkt) в качестве активированных проксимальных сигнальных молекул и фосфорилированные SHIP1 (pSHIP1) и SHP1 (pSHP1). как активированные тормозные сигнальные молекулы. Мы визуализируем области плазматической мембраны GCB, которые контактируют с PLB (зона контакта), используя микроскопию интерференционного отражения (IRM) и флуоресцентную микроскопию полного внутреннего отражения (TIRF), поскольку поверхностные BCR в зоне контакта могут напрямую взаимодействовать с Fab’-PLB.Мы сосредоточились на GCB светлой зоны (LZ), так как LZ — это место, где большинство GCB сталкиваются с антигеном на фолликулярных дендритных клетках. Мы выделили LZ GCB среди обогащенных GCB на основании их относительно низких уровней окрашивания CXCR4 (дополнительная фигура 3; Allen et al., 2004). Фосфорилированный CD79a был обнаружен в зоне контакта LZ GCB дикого типа (WT) и нокаута WASp (WKO) (рис. 1A), но не в зоне контакта GCB, взаимодействующих с Tf-PLB (дополнительная фигура 4). Как средняя интенсивность флуоресценции (MFI), так и общая интенсивность флуоресценции (TFI) pCD79a в зоне контакта отдельных LZ GCB увеличивались с течением времени, достигая максимума через ∼5 и ∼9 мин инкубации соответственно, и сохранялись по крайней мере в течение 20 мин.
как активированные тормозные сигнальные молекулы. Мы визуализируем области плазматической мембраны GCB, которые контактируют с PLB (зона контакта), используя микроскопию интерференционного отражения (IRM) и флуоресцентную микроскопию полного внутреннего отражения (TIRF), поскольку поверхностные BCR в зоне контакта могут напрямую взаимодействовать с Fab’-PLB.Мы сосредоточились на GCB светлой зоны (LZ), так как LZ — это место, где большинство GCB сталкиваются с антигеном на фолликулярных дендритных клетках. Мы выделили LZ GCB среди обогащенных GCB на основании их относительно низких уровней окрашивания CXCR4 (дополнительная фигура 3; Allen et al., 2004). Фосфорилированный CD79a был обнаружен в зоне контакта LZ GCB дикого типа (WT) и нокаута WASp (WKO) (рис. 1A), но не в зоне контакта GCB, взаимодействующих с Tf-PLB (дополнительная фигура 4). Как средняя интенсивность флуоресценции (MFI), так и общая интенсивность флуоресценции (TFI) pCD79a в зоне контакта отдельных LZ GCB увеличивались с течением времени, достигая максимума через ∼5 и ∼9 мин инкубации соответственно, и сохранялись по крайней мере в течение 20 мин. Рисунки 1А,Б).По сравнению с GCB WT, MFI pCD79a и TFI были значительно снижены в GCB WKO (рис. 1A, B). MFI и TFI pSyk, pAkt, pSHIP1 и pSHP1 со временем увеличивались в зоне контакта LZ GCB (дополнительная фигура 5). MFI и TFI pSyk увеличились так же, как и pCD79a, в то время как MFI и TFI pAkt, pSHIP1 и pSHP1 достигли максимума через 7, 3 и 3 минуты соответственно, а затем уменьшились (дополнительная фигура 5). По сравнению с GCB WT, GCB WKO имели значительно сниженные уровни pSyk и pSHP1, но повышенные уровни pSHIP1 без изменения уровня pAkt в зоне контакта (рис. 1C, D и дополнительная рис. 5).
Рисунки 1А,Б).По сравнению с GCB WT, MFI pCD79a и TFI были значительно снижены в GCB WKO (рис. 1A, B). MFI и TFI pSyk, pAkt, pSHIP1 и pSHP1 со временем увеличивались в зоне контакта LZ GCB (дополнительная фигура 5). MFI и TFI pSyk увеличились так же, как и pCD79a, в то время как MFI и TFI pAkt, pSHIP1 и pSHP1 достигли максимума через 7, 3 и 3 минуты соответственно, а затем уменьшились (дополнительная фигура 5). По сравнению с GCB WT, GCB WKO имели значительно сниженные уровни pSyk и pSHP1, но повышенные уровни pSHIP1 без изменения уровня pAkt в зоне контакта (рис. 1C, D и дополнительная рис. 5).
Рисунок 1. Нокаут WASp (WKO) снижает передачу сигналов BCR и искажает иммунологический синапс (IS) В-клеток зародышевого центра светлой зоны (LZ GCB). GCB, выделенные из эритроцитов барана (SRBC), иммунизированных мышей дикого типа (WT) и мышей WKO, инкубировали с конъюгированным с Alexa Fluor (AF) 546 монобиотинилированным Fab’-антимышиным IgM + G, связанными плоскими липидными бислоями (Fab’-PLB). ) при 37°C, фиксированные в разное время, пермеабилизированные, окрашенные на фосфорилированные CD79a (pCD79a), Syk (pSyk), Akt (pAkt), SHIP1 (pSHIP1) или SHP1 (pSHP1).Плазматическую мембрану GCB, контактирующую с Fab’-PLB (зона контакта), визуализировали с помощью микроскопа интерференционного отражения (IRM) и флуоресцентного микроскопа полного внутреннего отражения (TIRF). (A) Репрезентативные изображения IRM и TIRF GCB WT и WKO, окрашенные на pCD79a на 3, 5, 7, 9 и 20 мин. (B) Средняя интенсивность флуоресценции (MFI) и общая интенсивность флуоресценции (TFI) pCD79a в зоне контакта в разное время были количественно определены с помощью NIH ImageJ. Результаты представляли собой среднее значение (± стандартное отклонение) для > 60 отдельных клеток в каждом состоянии из шести независимых экспериментов. (C) Репрезентативные изображения IRM и TIRF GCB WT и WKO, окрашенные на pSyk, pAkt, pSHIP1 или pSHP1 через 7 мин. (D) MFI pSyk, pAkt, pSHIP1 и pSHP1 в зоне контакта через 7 минут измеряли с помощью NIH ImageJ.
) при 37°C, фиксированные в разное время, пермеабилизированные, окрашенные на фосфорилированные CD79a (pCD79a), Syk (pSyk), Akt (pAkt), SHIP1 (pSHIP1) или SHP1 (pSHP1).Плазматическую мембрану GCB, контактирующую с Fab’-PLB (зона контакта), визуализировали с помощью микроскопа интерференционного отражения (IRM) и флуоресцентного микроскопа полного внутреннего отражения (TIRF). (A) Репрезентативные изображения IRM и TIRF GCB WT и WKO, окрашенные на pCD79a на 3, 5, 7, 9 и 20 мин. (B) Средняя интенсивность флуоресценции (MFI) и общая интенсивность флуоресценции (TFI) pCD79a в зоне контакта в разное время были количественно определены с помощью NIH ImageJ. Результаты представляли собой среднее значение (± стандартное отклонение) для > 60 отдельных клеток в каждом состоянии из шести независимых экспериментов. (C) Репрезентативные изображения IRM и TIRF GCB WT и WKO, окрашенные на pSyk, pAkt, pSHIP1 или pSHP1 через 7 мин. (D) MFI pSyk, pAkt, pSHIP1 и pSHP1 в зоне контакта через 7 минут измеряли с помощью NIH ImageJ. Точки данных представляют отдельные ячейки. (E, F) Репрезентативные изображения IRM и TIRF WT и WKO, окрашенные на pCD79a (E) и pSyk (F) через 20 мин, а также плотность FI и IRM вдоль линий. На профилях линий черные стрелки указывают на внешний край зоны контакта.Зеленые стрелки указывают пики pCD79a или pSyk FI. (G) Увеличенные репрезентативные изображения IRM и TIRF центральных областей в GCB WT, окрашенных на pCD79a и pSyk, показаны в (E, F) . Звезды, участки плазматической мембраны, оторвавшиеся от Fab’-PLB. Красные стрелки — участки плазматической мембраны, которые находились в тесном контакте с Fab’-PLB. (H) GCB с централизованным окрашиванием pCD79a в зоне контакта идентифицировали с использованием трех случайно выбранных профилей линий FI на клетку. (I) Процент GCB с централизованным окрашиванием pCD79a.Точки данных представляют собой отдельные изображения на 5 мин. (J) Процентное содержание pCD79a FI и pSyk FI в центральной области указано в (H) .
Точки данных представляют отдельные ячейки. (E, F) Репрезентативные изображения IRM и TIRF WT и WKO, окрашенные на pCD79a (E) и pSyk (F) через 20 мин, а также плотность FI и IRM вдоль линий. На профилях линий черные стрелки указывают на внешний край зоны контакта.Зеленые стрелки указывают пики pCD79a или pSyk FI. (G) Увеличенные репрезентативные изображения IRM и TIRF центральных областей в GCB WT, окрашенных на pCD79a и pSyk, показаны в (E, F) . Звезды, участки плазматической мембраны, оторвавшиеся от Fab’-PLB. Красные стрелки — участки плазматической мембраны, которые находились в тесном контакте с Fab’-PLB. (H) GCB с централизованным окрашиванием pCD79a в зоне контакта идентифицировали с использованием трех случайно выбранных профилей линий FI на клетку. (I) Процент GCB с централизованным окрашиванием pCD79a.Точки данных представляют собой отдельные изображения на 5 мин. (J) Процентное содержание pCD79a FI и pSyk FI в центральной области указано в (H) . Точки данных представляют отдельные ячейки. Шкала баров, 3 мкм. Результаты представляли собой среднее значение (± стандартное отклонение) > 60 отдельных клеток на условие. n = 3∼4. * p < 0,05 и **** p < 0,0001, непарный критерий Стьюдента t или однофакторный дисперсионный анализ.
Точки данных представляют отдельные ячейки. Шкала баров, 3 мкм. Результаты представляли собой среднее значение (± стандартное отклонение) > 60 отдельных клеток на условие. n = 3∼4. * p < 0,05 и **** p < 0,0001, непарный критерий Стьюдента t или однофакторный дисперсионный анализ.
В зоне контакта GCB WT LZ pCD79a и pSyk в основном обнаруживались в виде многочисленных точек в центральной области (рис. 1E, F, верхние панели, зеленые стрелки в профиле линии FI) и внешнем крае контактной зоны (рис. 1E,F, верхние панели, черные стрелки на профиле линии FI).Центральная область, богатая pCD79a и pSyk, была окружена областью, бедной pCD79a и pSyk (рис. 1A, C, E, F). Окрашивание pSHP1 в зоне контакта имело сходные паттерны с pCD79a и pSyk, но pAkt выглядел как рассеянные точки, а pSHIP1 в основном располагался на внешнем краю зоны контакта (рис. 1C). WKO нарушил централизованную организацию pCD79a (рис. 1E) и pSyk (рис. 1F), но не повлиял на организацию ингибирующих сигнальных молекул pSHIP1 и pSHP1 (рис. 1C).Изображения IRM и их профили линий интенсивности показали изменчивость в центральной части области контакта (рис. 1E-G, левые панели). Ранее мы показали монотонную зависимость между интенсивностью IRM и высотой мембраны (Lam Hui et al., 2012). Интенсивность темного IRM представляет близкое прилегание клеточной мембраны к Fab’-PLB в пределах поля обнаружения TIRF, в то время как интенсивность светлого IRM представляет собой прилегание клеточной мембраны вдали от Fab’-PLB и поле дефекта TIRF. Таким образом, изменение интенсивности IRM указывает на выпячивание плазматической мембраны GCB в контакте с PLB (рис. 1E-G, левые панели).Наложение интенсивности IRM и профилей линий pCD79a или pSyk FI показало, что сигнальные точки были расположены в центральных выступах, которые тесно контактировали с Fab’-PLB, но гораздо меньше в области мембраны, окружающей центральные выступы, хотя они также взаимодействовали с F-ab. ‘-PLB (рис. 1E, F, зеленые стрелки и рис. 1G, красные стрелки). Хотя GCB WKO также образовывали сходные мембранные выпячивания в зоне контакта, они не были централизованными, менее организованными и ассоциированными с меньшим количеством сигнальных точек (рис.
1C).Изображения IRM и их профили линий интенсивности показали изменчивость в центральной части области контакта (рис. 1E-G, левые панели). Ранее мы показали монотонную зависимость между интенсивностью IRM и высотой мембраны (Lam Hui et al., 2012). Интенсивность темного IRM представляет близкое прилегание клеточной мембраны к Fab’-PLB в пределах поля обнаружения TIRF, в то время как интенсивность светлого IRM представляет собой прилегание клеточной мембраны вдали от Fab’-PLB и поле дефекта TIRF. Таким образом, изменение интенсивности IRM указывает на выпячивание плазматической мембраны GCB в контакте с PLB (рис. 1E-G, левые панели).Наложение интенсивности IRM и профилей линий pCD79a или pSyk FI показало, что сигнальные точки были расположены в центральных выступах, которые тесно контактировали с Fab’-PLB, но гораздо меньше в области мембраны, окружающей центральные выступы, хотя они также взаимодействовали с F-ab. ‘-PLB (рис. 1E, F, зеленые стрелки и рис. 1G, красные стрелки). Хотя GCB WKO также образовывали сходные мембранные выпячивания в зоне контакта, они не были централизованными, менее организованными и ассоциированными с меньшим количеством сигнальных точек (рис. 1E, F).Мы количественно оценили эту уникальную сигнальную организацию ИС GCB, определив процент LZ GCB с центральным обогащением pCD79a (рис. 1I) и процент pCD79a или pSyk FI в центральной области по сравнению со всей контактной зоной в отдельных клетках (рис. 1J). ), используя три случайно выбранных профиля линии FI на ячейку (рис. 1H). Почти 70% GCB WT LZ имели такую центральную организацию pCD79a по сравнению с ~ 20% GCB LZ WKO (рис. 1I). В центральной области контактной зоны WT GCB наблюдался значительно более высокий процент pCD79a и pSyk FI по сравнению с таковым в WKO GCB (рис. 1J).В совокупности эти данные свидетельствуют о том, что WASp имеет решающее значение для уникальной архитектуры ИС GCB.
1E, F).Мы количественно оценили эту уникальную сигнальную организацию ИС GCB, определив процент LZ GCB с центральным обогащением pCD79a (рис. 1I) и процент pCD79a или pSyk FI в центральной области по сравнению со всей контактной зоной в отдельных клетках (рис. 1J). ), используя три случайно выбранных профиля линии FI на ячейку (рис. 1H). Почти 70% GCB WT LZ имели такую центральную организацию pCD79a по сравнению с ~ 20% GCB LZ WKO (рис. 1I). В центральной области контактной зоны WT GCB наблюдался значительно более высокий процент pCD79a и pSyk FI по сравнению с таковым в WKO GCB (рис. 1J).В совокупности эти данные свидетельствуют о том, что WASp имеет решающее значение для уникальной архитектуры ИС GCB.
WASp способствует распространению GCB на антигенпрезентирующих поверхностях
В-клетки подвергаются актин-управляемому распространению при взаимодействии с антигенпрезентирующими поверхностями, увеличивая площадь контакта (Fleire et al., 2006). Мы использовали IRM для изучения роли WASp в распространении GCB. LZ GCB инкубировали с Fab’-PLB, а затем либо визуализировали после фиксации в разное время, либо визуализировали в реальном времени с помощью IRM.IRM-изображения фиксированных клеток показали, что GCB начинают связывать Fab’-PLB в течение 1 минуты, быстро распространяются и достигают максимальной площади контакта через 3 минуты (рис. 2A, B). Визуализация живых клеток была начата, когда GCB приземлились на Fab’-PLB, и для достижения максимального распространения GCB потребовалось менее 2 минут (рис. 2C, D и дополнительное видео 1). GCB WKO распространяются значительно меньше, чем GCB WT (рис. 2A–D и дополнительное видео 1). В отличие от сокращения наивных В-клеток после распространения (Fleire et al., 2006), как WT, так и WKO GCB сохраняли максимальную площадь контакта в течение не менее 20 минут (рис. 2A–D). Чтобы проанализировать кинетику распространения GCB, мы измерили начальную скорость распространения GCB, используя наклоны площади контакта в зависимости от графиков времени и линейной регрессии (рис.
LZ GCB инкубировали с Fab’-PLB, а затем либо визуализировали после фиксации в разное время, либо визуализировали в реальном времени с помощью IRM.IRM-изображения фиксированных клеток показали, что GCB начинают связывать Fab’-PLB в течение 1 минуты, быстро распространяются и достигают максимальной площади контакта через 3 минуты (рис. 2A, B). Визуализация живых клеток была начата, когда GCB приземлились на Fab’-PLB, и для достижения максимального распространения GCB потребовалось менее 2 минут (рис. 2C, D и дополнительное видео 1). GCB WKO распространяются значительно меньше, чем GCB WT (рис. 2A–D и дополнительное видео 1). В отличие от сокращения наивных В-клеток после распространения (Fleire et al., 2006), как WT, так и WKO GCB сохраняли максимальную площадь контакта в течение не менее 20 минут (рис. 2A–D). Чтобы проанализировать кинетику распространения GCB, мы измерили начальную скорость распространения GCB, используя наклоны площади контакта в зависимости от графиков времени и линейной регрессии (рис. 2E). Мы обнаружили, что GCB WKO распространяются значительно медленнее, чем GCB WT (рис. 2E, F), в дополнение к уменьшению максимальной площади контакта. Анализ проточной цитометрии показал, что GCB WT и WKO имели одинаковое прямое рассеяние (дополнительная фигура 6), что указывает на то, что сниженная скорость распространения и площадь GCB WKO не были вызваны уменьшением размеров GCB WKO.Мы также заметили, что GCB WKO потребовалось на несколько секунд больше, чем GCB WT, для перехода от приземления к связыванию с Fab’-PLB (рис. 2G). Время приземления и связывания клеток определяли с использованием покадровых изображений IRM. IRM обнаруживает тень, когда клетка приземляется на Fab’-PLB, но не находится достаточно близко для связывания, а когда клетка связывается с Fab’-PLB, тень на изображениях IRM становится темной. Эти данные предполагают, что WASp необходим для оптимальной кинетики и степени распространения GCB.
2E). Мы обнаружили, что GCB WKO распространяются значительно медленнее, чем GCB WT (рис. 2E, F), в дополнение к уменьшению максимальной площади контакта. Анализ проточной цитометрии показал, что GCB WT и WKO имели одинаковое прямое рассеяние (дополнительная фигура 6), что указывает на то, что сниженная скорость распространения и площадь GCB WKO не были вызваны уменьшением размеров GCB WKO.Мы также заметили, что GCB WKO потребовалось на несколько секунд больше, чем GCB WT, для перехода от приземления к связыванию с Fab’-PLB (рис. 2G). Время приземления и связывания клеток определяли с использованием покадровых изображений IRM. IRM обнаруживает тень, когда клетка приземляется на Fab’-PLB, но не находится достаточно близко для связывания, а когда клетка связывается с Fab’-PLB, тень на изображениях IRM становится темной. Эти данные предполагают, что WASp необходим для оптимальной кинетики и степени распространения GCB.
Рис. 2. WASp способствует распространению GCB на Fab’-PLB. GCB, выделенные от мышей, иммунизированных SRBC, инкубировали с Fab’-PLB и визуализировали либо после фиксации (A, B) , либо после фиксации (C – F) с помощью IRM. (A) Репрезентативные изображения IRM WT и WKO GCB, зафиксированные в указанное время. (B) Площади контакта фиксированных GCB на Fab’-PLB с течением времени измеряли с помощью NIH-ImageJ. Результаты представляли собой среднее значение (± стандартное отклонение) > 100 отдельных клеток в каждом состоянии из 7 независимых экспериментов. (C) Репрезентативные покадровые изображения IRM WT и WKO GCB. (D) Области контакта WT и WKO GCB с течением времени с использованием изображений IRM с интервальной съемкой и NIH ImageJ. Результаты представляли собой среднее значение (± стандартное отклонение) 20~30 отдельных клеток в каждом состоянии из четырех независимых экспериментов. (E) Начальная скорость распространения отдельных GCB была определена с использованием кривых зависимости наклона их площади контакта от времени методом линейной регрессии.
GCB, выделенные от мышей, иммунизированных SRBC, инкубировали с Fab’-PLB и визуализировали либо после фиксации (A, B) , либо после фиксации (C – F) с помощью IRM. (A) Репрезентативные изображения IRM WT и WKO GCB, зафиксированные в указанное время. (B) Площади контакта фиксированных GCB на Fab’-PLB с течением времени измеряли с помощью NIH-ImageJ. Результаты представляли собой среднее значение (± стандартное отклонение) > 100 отдельных клеток в каждом состоянии из 7 независимых экспериментов. (C) Репрезентативные покадровые изображения IRM WT и WKO GCB. (D) Области контакта WT и WKO GCB с течением времени с использованием изображений IRM с интервальной съемкой и NIH ImageJ. Результаты представляли собой среднее значение (± стандартное отклонение) 20~30 отдельных клеток в каждом состоянии из четырех независимых экспериментов. (E) Начальная скорость распространения отдельных GCB была определена с использованием кривых зависимости наклона их площади контакта от времени методом линейной регрессии. Показан пример. (F) Укрывистость ГЦБ WT и WKO на Fab’-PLB. (G) Репрезентативные изображения IRM (левые панели) клетки, которая только что приземлилась (белая тень) или начала связываться (темные пятна) с Fab’-PLB. Время между посадкой клетки и связыванием с Fab’-PLB (справа). Точки данных представляют отдельные ячейки. Показаны средние значения (± стандартное отклонение) для 20~30 отдельных клеток для каждого состояния. n = 4. Масштабные линейки, 3 мкм. * p < 0,05, ** p < 0,01 и **** p < 0,0001, непарный критерий Стьюдента t или однофакторный дисперсионный анализ.
Показан пример. (F) Укрывистость ГЦБ WT и WKO на Fab’-PLB. (G) Репрезентативные изображения IRM (левые панели) клетки, которая только что приземлилась (белая тень) или начала связываться (темные пятна) с Fab’-PLB. Время между посадкой клетки и связыванием с Fab’-PLB (справа). Точки данных представляют отдельные ячейки. Показаны средние значения (± стандартное отклонение) для 20~30 отдельных клеток для каждого состояния. n = 4. Масштабные линейки, 3 мкм. * p < 0,05, ** p < 0,01 и **** p < 0,0001, непарный критерий Стьюдента t или однофакторный дисперсионный анализ.
WASp способствует сбору антигенов и росту микрокластеров BCR-антигенов
При взаимодействии с антигеном на презентирующих поверхностях антиген-вовлеченные BCR агрегируют в микрокластеры, что приводит к активации передачи сигналов (Depoil et al., 2009; Tolar et al., 2009). Чтобы изучить роль WASp во время этого процесса в ГЦБ, мы определили относительное количество AF546-Fab’, собранных в зоне контакта отдельных клеток и в отдельных микрокластерах, а также скорость их увеличения. Поскольку AF546-Fab’ привязывался к кластерам PLB только при взаимодействии с поверхностными BCR (дополнительная фигура 4; Liu et al., 2012), кластеризация AF546-Fab’ отражает кластеризацию поверхностных BCR. GCB инкубировали с Fab’-PLB и визуализировали либо после фиксации в разное время, либо визуализировали вживую с помощью TIRF. MFI и TFI AF546-Fab’ фиксированных GCB WT и WKO достигли пика через 3–5 мин (рис. 3A–C), позже, чем время (<3 мин), когда GCB достигли максимального распространения (рис. 2B). WKO значительно снизила MFI и TFI AF546-Fab’ в зоне контакта с GCB (рис. 3A–C).Визуализация живых клеток подтвердила снижение MFI AF-546-Fab в зоне контакта GCB WKO (рисунки 3D, E и дополнительное видео 2). Кинетический анализ изображений с интервальной съемкой показал резкое снижение скорости увеличения MFI AF546-Fab в зоне контакта GCB WKO по сравнению с GCB WT (рис. 3D-F). Мы использовали кимографы отдельных клеток для анализа отслеживаемых микрокластеров AF546-Fab и измеряли их FI с течением времени (рис.
Поскольку AF546-Fab’ привязывался к кластерам PLB только при взаимодействии с поверхностными BCR (дополнительная фигура 4; Liu et al., 2012), кластеризация AF546-Fab’ отражает кластеризацию поверхностных BCR. GCB инкубировали с Fab’-PLB и визуализировали либо после фиксации в разное время, либо визуализировали вживую с помощью TIRF. MFI и TFI AF546-Fab’ фиксированных GCB WT и WKO достигли пика через 3–5 мин (рис. 3A–C), позже, чем время (<3 мин), когда GCB достигли максимального распространения (рис. 2B). WKO значительно снизила MFI и TFI AF546-Fab’ в зоне контакта с GCB (рис. 3A–C).Визуализация живых клеток подтвердила снижение MFI AF-546-Fab в зоне контакта GCB WKO (рисунки 3D, E и дополнительное видео 2). Кинетический анализ изображений с интервальной съемкой показал резкое снижение скорости увеличения MFI AF546-Fab в зоне контакта GCB WKO по сравнению с GCB WT (рис. 3D-F). Мы использовали кимографы отдельных клеток для анализа отслеживаемых микрокластеров AF546-Fab и измеряли их FI с течением времени (рис. 3G, стрелки). FI отдельных микрокластеров AF546-Fab’ в GCB WT и WKO достигла пика менее чем через 2 минуты и, по-видимому, достигла насыщения, поскольку уровни интенсивности в основном не изменились, по крайней мере, в течение следующих 5 минут (рис. 3H).Кроме того, большинство микрокластеров Fab’-BCR почти не двигались, и поэтому их можно было отслеживать в течение нескольких минут на отдельных кимографах (рис. 3G), что позволяет предположить, что они относительно неподвижны. FI и скорость увеличения FI в отдельных микрокластерах AF546-Fab’ в GCB WKO были значительно ниже, чем в GCB WT (рис. 3G-I). Чтобы определить, было ли снижение, наблюдаемое в WKO GCB, связано со снижением поверхностных уровней BCR, мы окрашивали спленоциты иммунизированных мышей на маркеры BCR (IgG), B-клеток (B220) и GCB (GL7 и CD95).Анализ проточной цитометрии показал, что уровень IgG на GCB WKO не снижался, а скорее слегка повышался по сравнению с GCB WT (дополнительная фигура 7). Таким образом, наши результаты предполагают, что WASp способствует сбору антигена, способствуя росту микрокластеров BCR, связанных с антигеном.
3G, стрелки). FI отдельных микрокластеров AF546-Fab’ в GCB WT и WKO достигла пика менее чем через 2 минуты и, по-видимому, достигла насыщения, поскольку уровни интенсивности в основном не изменились, по крайней мере, в течение следующих 5 минут (рис. 3H).Кроме того, большинство микрокластеров Fab’-BCR почти не двигались, и поэтому их можно было отслеживать в течение нескольких минут на отдельных кимографах (рис. 3G), что позволяет предположить, что они относительно неподвижны. FI и скорость увеличения FI в отдельных микрокластерах AF546-Fab’ в GCB WKO были значительно ниже, чем в GCB WT (рис. 3G-I). Чтобы определить, было ли снижение, наблюдаемое в WKO GCB, связано со снижением поверхностных уровней BCR, мы окрашивали спленоциты иммунизированных мышей на маркеры BCR (IgG), B-клеток (B220) и GCB (GL7 и CD95).Анализ проточной цитометрии показал, что уровень IgG на GCB WKO не снижался, а скорее слегка повышался по сравнению с GCB WT (дополнительная фигура 7). Таким образом, наши результаты предполагают, что WASp способствует сбору антигена, способствуя росту микрокластеров BCR, связанных с антигеном.
Рисунок 3. WASp способствует кластеризации BCR в ответ на Fab’-PLB. GCB, выделенные от мышей WT и WKO, иммунизированных SRBC, инкубировали с AF546-Fab’-PLB и визуализировали либо после фиксации в разное время, либо вживую с использованием TIRF. (A) Репрезентативные изображения AF546-Fab’ GCB, зафиксированные на 1, 3, 5 и 7 мин. (B,C) MFI (B) и TFI (C) из AF546-Fab’ в зоне контакта фиксированных GCB с течением времени с использованием NIH ImageJ. (D) Репрезентативные покадровые изображения AF546-Fab’ GCB WT и WKO. (E) MFI AF546-Fab’ в зоне контакта ПЦГ с течением времени. (F) Скорость увеличения AF546-Fab’ MFI в зоне контакта отдельных GCB определяли с использованием slops AF546-Fab’ по сравнению с AF546-Fab’.временные графики и линейная регрессия, как показано на рисунке 2E. Точки данных представляют отдельные ячейки. (G) Репрезентативные кимограммы, созданные с использованием изображений AF546-Fab с интервальной съемкой зоны контакта WT и WKO GCB с использованием NIH ImageJ. Белые стрелки — начало отдельных кластеров AF546-Fab. (H) FI AF546-Fab’ в отдельных кластерах с течением времени с использованием кимографов и NIH ImageJ. (I) . Скорость роста AF546-Fab’ FI в отдельных кластерах анализировали, как описано на Фигуре 2E.Точки данных представляют отдельные кластеры. Шкала баров, 3 мкм. Результаты представляли собой средние значения (± SD) 22~100 отдельных клеток (B,C,E) или > 120 кластеров BCR и 5 кластеров на кимограф на ячейку (H) для каждого состояния. n = 4~7. ** p < 0,01, *** p < 0,001 и **** p < 0,0001, непарный критерий Стьюдента t или односторонний ANOVA.
Белые стрелки — начало отдельных кластеров AF546-Fab. (H) FI AF546-Fab’ в отдельных кластерах с течением времени с использованием кимографов и NIH ImageJ. (I) . Скорость роста AF546-Fab’ FI в отдельных кластерах анализировали, как описано на Фигуре 2E.Точки данных представляют отдельные кластеры. Шкала баров, 3 мкм. Результаты представляли собой средние значения (± SD) 22~100 отдельных клеток (B,C,E) или > 120 кластеров BCR и 5 кластеров на кимограф на ячейку (H) для каждого состояния. n = 4~7. ** p < 0,01, *** p < 0,001 и **** p < 0,0001, непарный критерий Стьюдента t или односторонний ANOVA.
WASp необходим для формирования и стабилизации актиновых фокусов, поддерживающих централизованные мембранные выпячивания
WASp является фактором, способствующим нуклеации актина, который активирует Arp2/3-опосредованную полимеризацию разветвленного актина (Padrick and Rosen, 2010).Мы оценили вклад WASp в реорганизацию актина во время ответа GCB на антигенпрезентирующие поверхности с использованием окрашивания фаллоидином и GCB от мышей, экспрессирующих Lifeact-GFP. И фаллоидин, и Lifeact-GFP связываются с F-актином, но окрашивание фаллоидином требует фиксации клеток и проницаемости мембран (Riedl et al., 2008; Melak et al., 2017). Анализ изображений TIRF показал, что MFI окрашивания фаллоидином в зоне контакта GCB, фиксированных в разное время, быстро увеличивалась при взаимодействии с Fab’-PLB и достигала пика до 1 мин (рис. 4A, B).MFI Lifeact-GFP в зоне контакта GCB, отображаемых вживую, увеличивалась относительно медленно (рис. 4C, D и дополнительное видео 3). Однако MFI как фаллоидина, так и Lifeact-GFP в зоне контакта GCB WKO были значительно снижены по сравнению с таковыми у GCB WT (рис. 4A–D и дополнительное видео 3). Кроме того, начальная скорость увеличения Lifeact-GFP в зоне контакта WKO GCB была значительно ниже, чем в зоне контакта WT GCB (рис. 4E). Таким образом, WASp в первую очередь участвует в быстром накоплении F-актина в зоне контакта GCB.
И фаллоидин, и Lifeact-GFP связываются с F-актином, но окрашивание фаллоидином требует фиксации клеток и проницаемости мембран (Riedl et al., 2008; Melak et al., 2017). Анализ изображений TIRF показал, что MFI окрашивания фаллоидином в зоне контакта GCB, фиксированных в разное время, быстро увеличивалась при взаимодействии с Fab’-PLB и достигала пика до 1 мин (рис. 4A, B).MFI Lifeact-GFP в зоне контакта GCB, отображаемых вживую, увеличивалась относительно медленно (рис. 4C, D и дополнительное видео 3). Однако MFI как фаллоидина, так и Lifeact-GFP в зоне контакта GCB WKO были значительно снижены по сравнению с таковыми у GCB WT (рис. 4A–D и дополнительное видео 3). Кроме того, начальная скорость увеличения Lifeact-GFP в зоне контакта WKO GCB была значительно ниже, чем в зоне контакта WT GCB (рис. 4E). Таким образом, WASp в первую очередь участвует в быстром накоплении F-актина в зоне контакта GCB.
Рис. 4. WASp участвует в накоплении F-актина в зоне контакта GCB. (A, B) GCB, выделенные из SRBC-иммунизированных мышей WT и WKO, инкубировали с Fab’-PLB, фиксировали, подвергали пермеабилизации, окрашивали на F-актин фаллоидином и визуализировали с использованием IRM и TIRF. Показаны репрезентативные изображения (A) и MFI фаллоидина в зоне контакта GCB в разное время (B) . (C–E) GCB, выделенные из SRBC-иммунизированных мышей WT и WKO, экспрессирующих Lifeact-GFP, инкубировали с Fab’-PLB и визуализировали вживую с помощью TIRF.Показаны репрезентативные покадровые TIRF-изображения Lifeact-GFP (C) , MFI Lifeact-GFP в зоне контакта с течением времени (D) и возрастающие скорости MFI Lifeact-GFP, измеренные, как показано на Рисунок 2Е. Точки данных представляют отдельные ячейки. Шкала баров, 3 мкм. Результаты представляли собой среднее значение (± стандартное отклонение) от 22 до 50 отдельных клеток в каждом состоянии. n = 4. ** p < 0,01, *** p < 0,001 и **** p < 0,0001, непарный критерий Стьюдента t или односторонний ANOVA.
(A, B) GCB, выделенные из SRBC-иммунизированных мышей WT и WKO, инкубировали с Fab’-PLB, фиксировали, подвергали пермеабилизации, окрашивали на F-актин фаллоидином и визуализировали с использованием IRM и TIRF. Показаны репрезентативные изображения (A) и MFI фаллоидина в зоне контакта GCB в разное время (B) . (C–E) GCB, выделенные из SRBC-иммунизированных мышей WT и WKO, экспрессирующих Lifeact-GFP, инкубировали с Fab’-PLB и визуализировали вживую с помощью TIRF.Показаны репрезентативные покадровые TIRF-изображения Lifeact-GFP (C) , MFI Lifeact-GFP в зоне контакта с течением времени (D) и возрастающие скорости MFI Lifeact-GFP, измеренные, как показано на Рисунок 2Е. Точки данных представляют отдельные ячейки. Шкала баров, 3 мкм. Результаты представляли собой среднее значение (± стандартное отклонение) от 22 до 50 отдельных клеток в каждом состоянии. n = 4. ** p < 0,01, *** p < 0,001 и **** p < 0,0001, непарный критерий Стьюдента t или односторонний ANOVA.
Предыдущие исследования показали, что GCB IS состоит из богатых актином выпячиваний, взаимодействующих с антигеном на предлежащих поверхностях (Nowosad et al., 2016; Kwak et al., 2018). В соответствии с этими ранними выводами мы обнаружили, что точки F-актина, наблюдаемые с помощью окрашивания фаллоидином, сконцентрированы в центральной области контактной зоны WT GCB (рис. 5А), где также были расположены сигнальные точки (рис. 1). Наложение профилей линий интенсивности фаллоидина FI и IRM показало совместную локализацию очагов F-актина с более темными областями изображений IRM, где мембрана GCB находилась в непосредственной близости от антигенпрезентирующих поверхностей (рис. 5A, B, зеленые стрелки).Однако мы не обнаружили таких фокусов F-актина в области мембраны GCB, окружающей центральные выступы, хотя интенсивность IRM показала его взаимодействие с Fab’-PLB (рис. 5A, B). Мы идентифицировали локальные области обогащения актином как очаги F-актина, близкие к Fab’-PLB, если их MFI фаллоидина (рис. 5C) и Lifeact-GFP (рис. 5E) был в 2 и 1,5 раза выше, чем MFI фаллоидина и Lifeact-GFP в течение всей контактной зоны соответственно. Мы обнаружили значительно большее количество таких очагов F-актина в центре WT, чем в зоне контакта WKO (рис. 5A-F).Это уменьшенное количество фокусов F-актина было связано с уменьшением процента окрашивания фаллоидином в центре контактной зоны WKO GCB по сравнению с таковым в контактной зоне WT GCB (рис. 5G). Мы исследовали формирование этих централизованных очагов актина с помощью кимографов, полученных из покадровых изображений GCB, экспрессирующих Lifeact-GFP (рис. 5H). Мы обнаружили, что ∼70% GCB дикого типа формируют очаги F-актина в течение первой минуты взаимодействия с антигенпрезентирующими поверхностями. Эти фокусы F-актина постепенно становились централизованными и обнаруживались до 20 минут (стабильно) (рис. 5H, левые панели и рис. 5I).В остальных GCB WT формировались фокусы F-актина, но они не сохранялись очень долго (нестабильно) (рис. 5H, средние панели и рис.
5C) и Lifeact-GFP (рис. 5E) был в 2 и 1,5 раза выше, чем MFI фаллоидина и Lifeact-GFP в течение всей контактной зоны соответственно. Мы обнаружили значительно большее количество таких очагов F-актина в центре WT, чем в зоне контакта WKO (рис. 5A-F).Это уменьшенное количество фокусов F-актина было связано с уменьшением процента окрашивания фаллоидином в центре контактной зоны WKO GCB по сравнению с таковым в контактной зоне WT GCB (рис. 5G). Мы исследовали формирование этих централизованных очагов актина с помощью кимографов, полученных из покадровых изображений GCB, экспрессирующих Lifeact-GFP (рис. 5H). Мы обнаружили, что ∼70% GCB дикого типа формируют очаги F-актина в течение первой минуты взаимодействия с антигенпрезентирующими поверхностями. Эти фокусы F-актина постепенно становились централизованными и обнаруживались до 20 минут (стабильно) (рис. 5H, левые панели и рис. 5I).В остальных GCB WT формировались фокусы F-актина, но они не сохранялись очень долго (нестабильно) (рис. 5H, средние панели и рис. 5I). Напротив, только около 14% GCB WKO сформировали стабильные центральные очаги F-актина (рис. 5I). Мы не обнаружили каких-либо централизованных очагов F-актина в ~43% GCB WKO (рис. 5H, правые панели и рис. 5I). Остальные GCB WKO демонстрировали нестабильные очаги F-актина (рис. 5H, средние панели и рис. 5I). Мы оценили относительное время жизни очагов F-актина, измерив продолжительность отдельных очагов F-актина, которые можно было обнаружить на случайно выбранных кимографах GCB, и их тепловых картах интенсивности (рис. 5J, стрелки).Относительное время жизни очагов F-актина в GCB WKO было намного короче, чем в GCB WT (Рисунки 5J, K). Эти данные указывают на то, что WASp необходим для генерации и стабилизации централизованных очагов F-актина, поддерживающих выпячивания мембраны GCB, которые взаимодействуют с антигеном на представленных поверхностях.
5I). Напротив, только около 14% GCB WKO сформировали стабильные центральные очаги F-актина (рис. 5I). Мы не обнаружили каких-либо централизованных очагов F-актина в ~43% GCB WKO (рис. 5H, правые панели и рис. 5I). Остальные GCB WKO демонстрировали нестабильные очаги F-актина (рис. 5H, средние панели и рис. 5I). Мы оценили относительное время жизни очагов F-актина, измерив продолжительность отдельных очагов F-актина, которые можно было обнаружить на случайно выбранных кимографах GCB, и их тепловых картах интенсивности (рис. 5J, стрелки).Относительное время жизни очагов F-актина в GCB WKO было намного короче, чем в GCB WT (Рисунки 5J, K). Эти данные указывают на то, что WASp необходим для генерации и стабилизации централизованных очагов F-актина, поддерживающих выпячивания мембраны GCB, которые взаимодействуют с антигеном на представленных поверхностях.
Рисунок 5. WASp необходим для создания стабильных очагов F-актина на центральных мембранных выпячиваниях в зоне контакта GCB. GCB, выделенные из SRBC-иммунизированных мышей WT и WKO, экспрессирующих или не экспрессирующих Lifeact-GFP, инкубировали с Fab’-PLB и либо фиксировали, подвергали пермеабилизации, окрашивали фаллоидином и визуализировали, либо визуализировали вживую с использованием IRM и TIRF. (A) Репрезентативные изображения IRM и TIRF окрашивания фаллоидином GCB WT и WKO на 7 мин и увеличенные изображения центральной области в зоне контакта GCB WT (левые панели). Звездочка * — участки плазматической мембраны, оторванные от Fab’-PLB. Красные стрелки — участки плазматической мембраны, находящиеся в тесном контакте с Fab’-PLB. (B) FI окрашивания фаллоидином и плотность изображения IRM вдоль линий со стрелками клеток WT (вверху) и WKO (внизу) в (A) . (C) Репрезентативные изображения фиксированных GCB, окрашенных фаллоидином, и их центральная область контактной зоны через 7 мин.Красные стрелки, окрашенные фаллоидином Очаги F-актина, выявленные по ИТР отдельных очагов, которые в 2 раза превышали ИТР всей зоны контакта.
GCB, выделенные из SRBC-иммунизированных мышей WT и WKO, экспрессирующих или не экспрессирующих Lifeact-GFP, инкубировали с Fab’-PLB и либо фиксировали, подвергали пермеабилизации, окрашивали фаллоидином и визуализировали, либо визуализировали вживую с использованием IRM и TIRF. (A) Репрезентативные изображения IRM и TIRF окрашивания фаллоидином GCB WT и WKO на 7 мин и увеличенные изображения центральной области в зоне контакта GCB WT (левые панели). Звездочка * — участки плазматической мембраны, оторванные от Fab’-PLB. Красные стрелки — участки плазматической мембраны, находящиеся в тесном контакте с Fab’-PLB. (B) FI окрашивания фаллоидином и плотность изображения IRM вдоль линий со стрелками клеток WT (вверху) и WKO (внизу) в (A) . (C) Репрезентативные изображения фиксированных GCB, окрашенных фаллоидином, и их центральная область контактной зоны через 7 мин.Красные стрелки, окрашенные фаллоидином Очаги F-актина, выявленные по ИТР отдельных очагов, которые в 2 раза превышали ИТР всей зоны контакта.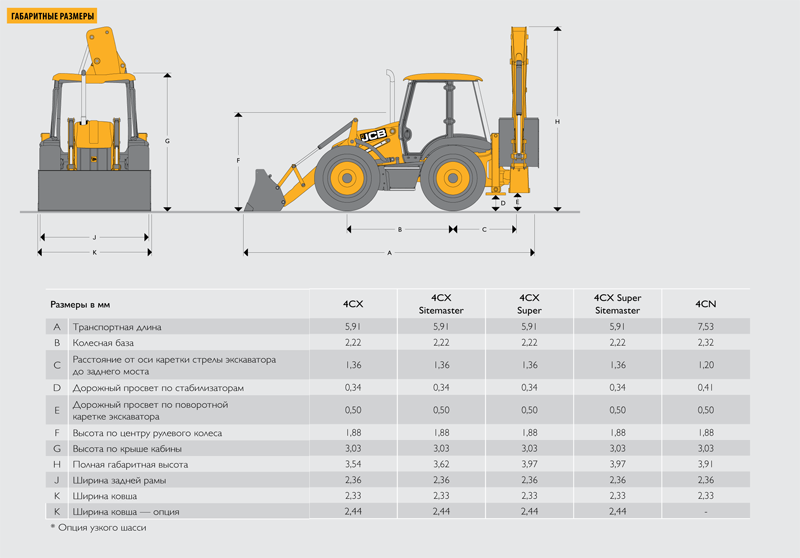 (D) Количество окрашенных фаллоидином очагов F-актина на контактную зону GCB через 7 мин. Точки данных представляют отдельные ячейки. (E) Репрезентативные изображения Lifeact-GFP, экспрессирующие GCB и их увеличенную центральную область контактной зоны на 7 мин. Красные стрелки, очаги F-актина Lifeact-GFP, определенные с помощью MFI отдельных очагов, которые были 1.в 5 раз выше, чем ПТР всей зоны контакта. (F) Количество очагов Lifeact-GFP на контактную зону GCB на 3, 5 и 7 мин. Точки данных представляют отдельные ячейки. (G) Процентное содержание фаллоидина FI в центральной области по отношению к фаллоидину TFI в контактной зоне. Точки данных представляют отдельные ячейки. (H) Репрезентативные кимограммы, полученные из покадровых изображений GCB Lifeact-GFP с помощью профилей линий TIRF и Lifeact-GFP FI на 5 мин (линии белых стрелок), чтобы показать три фенотипа: стабильный, нестабильный и без центральных очагов Lifeact.Черные стрелки на линейных профилях указывают на внешние края контактной зоны ПЦГ.
(D) Количество окрашенных фаллоидином очагов F-актина на контактную зону GCB через 7 мин. Точки данных представляют отдельные ячейки. (E) Репрезентативные изображения Lifeact-GFP, экспрессирующие GCB и их увеличенную центральную область контактной зоны на 7 мин. Красные стрелки, очаги F-актина Lifeact-GFP, определенные с помощью MFI отдельных очагов, которые были 1.в 5 раз выше, чем ПТР всей зоны контакта. (F) Количество очагов Lifeact-GFP на контактную зону GCB на 3, 5 и 7 мин. Точки данных представляют отдельные ячейки. (G) Процентное содержание фаллоидина FI в центральной области по отношению к фаллоидину TFI в контактной зоне. Точки данных представляют отдельные ячейки. (H) Репрезентативные кимограммы, полученные из покадровых изображений GCB Lifeact-GFP с помощью профилей линий TIRF и Lifeact-GFP FI на 5 мин (линии белых стрелок), чтобы показать три фенотипа: стабильный, нестабильный и без центральных очагов Lifeact.Черные стрелки на линейных профилях указывают на внешние края контактной зоны ПЦГ.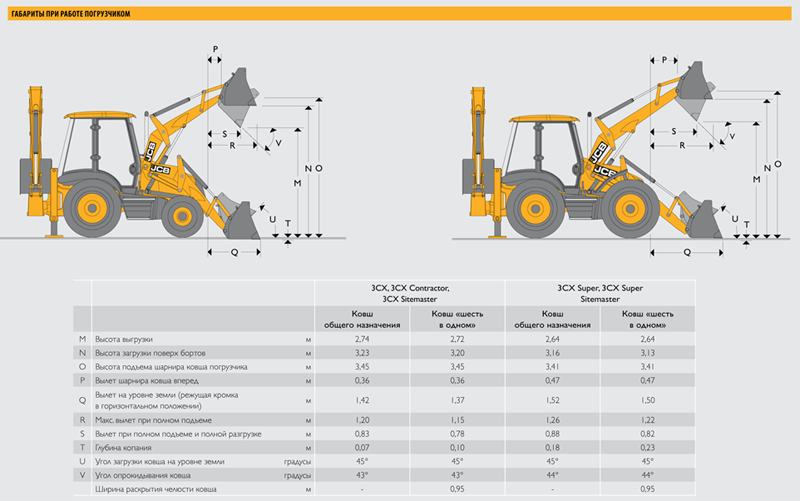 (I) Процент клеток со стабильными, нестабильными очагами и без очагов Lifeact в центре контактной зоны. Точки данных представляют собой независимые эксперименты. (J) Репрезентативные кимограммы GCB, экспрессирующих Lifeact-GFP, и их тепловые карты интенсивности от 4 до 6 мин. Стрелки, треки отдельных актиновых фокусов Lifeact-GFP. (K) Относительное время жизни очагов F-актина Lifeact-GFP измеряли по продолжительности отдельных очагов, которые можно было отследить на случайно выбранном кимографе.Точки данных представляют собой отдельные клетки, в среднем по 3 очага на ячейку. Шкала баров, 3 мкм. Результаты представляли собой среднее значение (± стандартное отклонение) от 20 до 30 отдельных клеток в каждом состоянии. n = 3∼4. ** p < 0,01, *** p < 0,001 и **** p < 0,0001, непарный критерий Стьюдента t или односторонний ANOVA.
(I) Процент клеток со стабильными, нестабильными очагами и без очагов Lifeact в центре контактной зоны. Точки данных представляют собой независимые эксперименты. (J) Репрезентативные кимограммы GCB, экспрессирующих Lifeact-GFP, и их тепловые карты интенсивности от 4 до 6 мин. Стрелки, треки отдельных актиновых фокусов Lifeact-GFP. (K) Относительное время жизни очагов F-актина Lifeact-GFP измеряли по продолжительности отдельных очагов, которые можно было отследить на случайно выбранном кимографе.Точки данных представляют собой отдельные клетки, в среднем по 3 очага на ячейку. Шкала баров, 3 мкм. Результаты представляли собой среднее значение (± стандартное отклонение) от 20 до 30 отдельных клеток в каждом состоянии. n = 3∼4. ** p < 0,01, *** p < 0,001 и **** p < 0,0001, непарный критерий Стьюдента t или односторонний ANOVA.
WASp участвует в актиновом цитоскелете, поддерживающем ламеллоподии и прилегающую область, окружающую центральные выступы
В дополнение к централизованным очагам F-актина мы наблюдали актиновые структуры на внешнем крае контактной зоны, поддерживающие распространяющуюся мембрану (рис. 6А и дополнительное видео 3).Мы определили их относительное время жизни с помощью кимографов, полученных из покадровых изображений GCB, экспрессирующих Lifeact-GFP (рис. 6A), как описано для относительного времени жизни центральных очагов F-актина. Подобно центральным очагам F-актина, актиновые структуры на внешнем крае контактной зоны WKO GCB имели значительно более короткое время жизни, чем у WT GCB (рис. 6B). Далее мы измерили количество пиков Lifeact-GFP FI в минуту (рис. 6C, D) и стандартное отклонение времени между двумя пиками Lifeact-GFP (рис. 6C, E) с использованием кимографов, чтобы отразить частоту и регулярность этого актина. структуры на переднем крае спрединговой мембраны.Мы обнаружили, что пики FI Lifeact-GFP появлялись на внешнем краю контактной зоны ПЦБ WKO гораздо реже и с меньшей регулярностью, чем пики в ПЦД WT (рис. 6C–E). Чтобы изучить влияние таких изменений в актиновом цитоскелете, вызванных WKO, на взаимодействие GCB с антигенпрезентирующими поверхностями, мы проанализировали замедленные изображения IRM с использованием кимографов (рис.
6А и дополнительное видео 3).Мы определили их относительное время жизни с помощью кимографов, полученных из покадровых изображений GCB, экспрессирующих Lifeact-GFP (рис. 6A), как описано для относительного времени жизни центральных очагов F-актина. Подобно центральным очагам F-актина, актиновые структуры на внешнем крае контактной зоны WKO GCB имели значительно более короткое время жизни, чем у WT GCB (рис. 6B). Далее мы измерили количество пиков Lifeact-GFP FI в минуту (рис. 6C, D) и стандартное отклонение времени между двумя пиками Lifeact-GFP (рис. 6C, E) с использованием кимографов, чтобы отразить частоту и регулярность этого актина. структуры на переднем крае спрединговой мембраны.Мы обнаружили, что пики FI Lifeact-GFP появлялись на внешнем краю контактной зоны ПЦБ WKO гораздо реже и с меньшей регулярностью, чем пики в ПЦД WT (рис. 6C–E). Чтобы изучить влияние таких изменений в актиновом цитоскелете, вызванных WKO, на взаимодействие GCB с антигенпрезентирующими поверхностями, мы проанализировали замедленные изображения IRM с использованием кимографов (рис. 6F). В зоне контакта GCB WT мы наблюдали темную область шириной ~ 2 мкм (указывающую на адгезию плазматической мембраны GCB к антигенпрезентирующим поверхностям), окружающую центральные выступы после достижения максимальной площади распространения (рис. 6F, верхние панели, красные стрелки). .Ширина этой адгезионной области в GCB WKO оказалась более изменчивой с течением времени и более асимметричной, чем в GCB WT (рис. 6F, нижние панели, красные стрелки). Чтобы внимательно изучить эту слипшуюся область, мы определили соотношение ширины слипшейся области на двух противоположных сторонах в отдельных контактных зонах на 3, 5, 7 и 10 мин (рис. 6G) и кратное изменение ширины слипшейся области между 5 и 7 мин (рис. 6H). GCB WKO продемонстрировали значительно более высокие отношения ширины области слипания между двумя сторонами отдельных контактных зон (рис. 6G) и значительно большие изменения кратности между 5 и 7 минутами (рис. 6H), чем GCB WT.Эти результаты предполагают, что WKO дестабилизирует эту адгезивную область.
6F). В зоне контакта GCB WT мы наблюдали темную область шириной ~ 2 мкм (указывающую на адгезию плазматической мембраны GCB к антигенпрезентирующим поверхностям), окружающую центральные выступы после достижения максимальной площади распространения (рис. 6F, верхние панели, красные стрелки). .Ширина этой адгезионной области в GCB WKO оказалась более изменчивой с течением времени и более асимметричной, чем в GCB WT (рис. 6F, нижние панели, красные стрелки). Чтобы внимательно изучить эту слипшуюся область, мы определили соотношение ширины слипшейся области на двух противоположных сторонах в отдельных контактных зонах на 3, 5, 7 и 10 мин (рис. 6G) и кратное изменение ширины слипшейся области между 5 и 7 мин (рис. 6H). GCB WKO продемонстрировали значительно более высокие отношения ширины области слипания между двумя сторонами отдельных контактных зон (рис. 6G) и значительно большие изменения кратности между 5 и 7 минутами (рис. 6H), чем GCB WT.Эти результаты предполагают, что WKO дестабилизирует эту адгезивную область. Таким образом, WASp вносит вклад в актиновую цитоскелетную сеть, которая поддерживает адгезию GCB к антигенпрезентирующим поверхностям, тем самым стабилизируя IS.
Таким образом, WASp вносит вклад в актиновую цитоскелетную сеть, которая поддерживает адгезию GCB к антигенпрезентирующим поверхностям, тем самым стабилизируя IS.
Рисунок 6. WASp необходим для образования устойчивой адгезионной области, окружающей центральную сигналосому. GCB, выделенные от мышей Lifeact-GFP, иммунизированных SRBC, инкубировали с Fab’-PLB и визуализировали вживую с использованием IRM и TIRF. (A) Репрезентативные кимографы с 2.от 5 до 4,5 минут, и их тепловые карты интенсивности, созданные из изображений с интервальной съемкой Lifeact-GFP. Белый ящик, периферийные области на 1 мин. Черные стрелки, следы очагов Lifeact в краевой области. (B) Относительное время жизни очагов Lifeact-GFP оценивали по продолжительности существования очагов Lifeact-GFP, обнаруженных на случайно выбранных кимографах. Точки данных представляют собой отдельные клетки, среднее значение 8-10 треков очагов Lifeact на ячейку. (C) Репрезентативные кимографы Lifeact-GFP (от центра к периферии контактной зоны). Белый ящик, периферические области между 3 и 6 мин. FI в периферической области (белый прямоугольник) с течением времени показан на правых панелях. Черные стрелки, отдельные пики Lifeact-GFP FI. (D) Количество пиков FI Lifeact-GFP в минуту между 3 и 6 мин. (E) Стандартное отклонение (SD) временных интервалов между пиками. (F) Репрезентативные изображения IRM на 7 мин и кимограммы, полученные из замедленных изображений IRM WT и WKO GCB. Желтыми пунктирными линиями обозначена граница между периферией и центром зоны контакта в зависимости от плотности IRM.Красные стрелки указывают ширину периферийной области. Белая стрелка, время. (G) Отношение ширины периферии на более широкой стороне к ширине на узкой стороне. Точки данных представляют собой среднее значение отношений через 3, 5, 7 и 10 минут в отдельных ячейках. (H) Разность изменения ширины периферии между 5 и 7 мин. Точки данных представляют отдельные ячейки. Шкала баров, 3 мкм. Результаты представляли собой среднее значение (± стандартное отклонение) от 20 до 30 отдельных клеток в каждом состоянии.
Белый ящик, периферические области между 3 и 6 мин. FI в периферической области (белый прямоугольник) с течением времени показан на правых панелях. Черные стрелки, отдельные пики Lifeact-GFP FI. (D) Количество пиков FI Lifeact-GFP в минуту между 3 и 6 мин. (E) Стандартное отклонение (SD) временных интервалов между пиками. (F) Репрезентативные изображения IRM на 7 мин и кимограммы, полученные из замедленных изображений IRM WT и WKO GCB. Желтыми пунктирными линиями обозначена граница между периферией и центром зоны контакта в зависимости от плотности IRM.Красные стрелки указывают ширину периферийной области. Белая стрелка, время. (G) Отношение ширины периферии на более широкой стороне к ширине на узкой стороне. Точки данных представляют собой среднее значение отношений через 3, 5, 7 и 10 минут в отдельных ячейках. (H) Разность изменения ширины периферии между 5 и 7 мин. Точки данных представляют отдельные ячейки. Шкала баров, 3 мкм. Результаты представляли собой среднее значение (± стандартное отклонение) от 20 до 30 отдельных клеток в каждом состоянии. n = 4. ** p < 0.01, *** p < 0,001 и **** p < 0,0001, непарный критерий Стьюдента t или односторонний ANOVA.
n = 4. ** p < 0.01, *** p < 0,001 и **** p < 0,0001, непарный критерий Стьюдента t или односторонний ANOVA.
Обсуждение
Зародышевые центры имеют решающее значение для отбора высокоаффинных антиген-специфических В-клеток и элиминации неспецифических В-клеток, образующихся во время соматической гипермутации (Victora and Nussenzweig, 2012; Mesin et al., 2016). Отсутствие гуморального ответа на вакцинацию и инфекции, а также накопление аутоантител у пациентов с WAS и на мышах предполагает нарушение процесса созревания аффинности у GCB (Notarangelo et al., 2008; Бостикардо и др., 2009 г.; Беккер-Херман и др., 2011). Это исследование показало, что WASp необходим для построения уникальной архитектуры GCB IS. WASp отвечает за создание и стабилизацию актиновых структур, которые поддерживают и поддерживают выпячивания мембраны в центре GCB IS. WASp также вносит вклад в актиновые структуры, которые управляют распространением и адгезией GCB к антигенпрезентирующим поверхностям, стабилизируя IS GCB. GCB полагаются на эту уникальную архитектуру IS, чтобы различать аффинность антигена, представленного на поверхности антигенпрезентирующих клеток, активировать передачу сигналов BCR и захватывать антиген для процессинга и презентации (Nowosad et al., 2016; Квак и др., 2018).
GCB полагаются на эту уникальную архитектуру IS, чтобы различать аффинность антигена, представленного на поверхности антигенпрезентирующих клеток, активировать передачу сигналов BCR и захватывать антиген для процессинга и презентации (Nowosad et al., 2016; Квак и др., 2018).
Недавние исследования показали, что GCB из миндалин человека и селезенки мыши взаимодействуют с мембранным антигеном через стручковидные выпячивания мембраны, богатые актином, и формируют микрокластеры BCR на кончиках этих выпячиваний (Nowosad et al., 2016; Kwak et al., 2018) . Эта организация отличается от наивной В-клеточной ИС. Плазматическая мембрана наивных В-клеток, взаимодействующая с антигенпрезентирующими поверхностями, относительно гладкая, что позволяет микрокластерам BCR сливаться в центральный кластер.Напротив, стручковидные выступы мембраны препятствуют росту и слиянию микрокластеров BCR. Было показано, что эта уникальная архитектура GCB IS обеспечивает повышенную способность GCB ощущать их аффинность связывания с антигеном, поскольку стабильность стручковидных мембранных выступов увеличивается с аффинностью антигена (Nowosad et al. , 2016; Kwak et al., 2018). . Используя визуализацию IRM и TIRF с высоким разрешением, это исследование расширяет эти результаты, показывая, что эти мембранные выступы концентрируются в центре контактной зоны GCB и относительно стабильны, когда GCB взаимодействуют с PLB, покрытыми относительно высокой плотностью Fab’-фрагмента антигена. -IgM+G антитела.Поскольку PLB обеспечивают связывание с высокой авидностью с поверхностными BCR, централизованные, стабильные выступы, вероятно, отражают характеристики IS в GCB, взаимодействующих с высокоаффинным антигеном. Каким образом антигенное сродство и жесткость антигенпрезентирующих поверхностей влияют на архитектуру GCB IS, остается интересным вопросом.
, 2016; Kwak et al., 2018). . Используя визуализацию IRM и TIRF с высоким разрешением, это исследование расширяет эти результаты, показывая, что эти мембранные выступы концентрируются в центре контактной зоны GCB и относительно стабильны, когда GCB взаимодействуют с PLB, покрытыми относительно высокой плотностью Fab’-фрагмента антигена. -IgM+G антитела.Поскольку PLB обеспечивают связывание с высокой авидностью с поверхностными BCR, централизованные, стабильные выступы, вероятно, отражают характеристики IS в GCB, взаимодействующих с высокоаффинным антигеном. Каким образом антигенное сродство и жесткость антигенпрезентирующих поверхностей влияют на архитектуру GCB IS, остается интересным вопросом.
Это исследование дополнительно показывает, что активированные сигнальные молекулы, включая как позитивные (CD79, Syk и Akt), так и негативные (SHP1) сигнальные молекулы, появляются на выступах в сходное время.Пиковые уровни фосфорилированного CD79a и Syk сохраняются по крайней мере в течение 20 мин. Напротив, стимулирующие киназы в наивных В-клетках, взаимодействующих с тем же типом Fab’-PLB, сначала активируются, а затем подавляются активированными фосфатазами (Liu et al., 2011, 2013a; Seeley-Fallen et al., 2014). . Наши результаты согласуются с предыдущим наблюдением о том, что активность фосфатаз повышается в GCB (Khalil et al., 2012) и увеличивается в то же время, что и стимулирующие киназы в ответ на антигенную стимуляцию (Kwak et al., 2018). Вместе эти данные предполагают, что фосфатазы SHP1 и SHIP1 работают со стимулирующими киназами, чтобы регулировать уровень персистирующей передачи сигналов BCR в В-клетках зародышевого центра, а не деактивировать передачу сигналов BCR в наивных В-клетках. Мы также заметили, что стимулирующие киназы и ингибирующие фосфатазы по-разному распределяются в выступах мембраны, даже если они активируются в GCBs одновременно. Активированные CD79, Syk и SHP1 заполняют контактную область мембранных выступов и внешний край контактной зоны, в то время как активированные Akt и SHIP1 проявляются в виде точек, редко украшая мембранные выступы и внешний край контактной зоны соответственно.
Напротив, стимулирующие киназы в наивных В-клетках, взаимодействующих с тем же типом Fab’-PLB, сначала активируются, а затем подавляются активированными фосфатазами (Liu et al., 2011, 2013a; Seeley-Fallen et al., 2014). . Наши результаты согласуются с предыдущим наблюдением о том, что активность фосфатаз повышается в GCB (Khalil et al., 2012) и увеличивается в то же время, что и стимулирующие киназы в ответ на антигенную стимуляцию (Kwak et al., 2018). Вместе эти данные предполагают, что фосфатазы SHP1 и SHIP1 работают со стимулирующими киназами, чтобы регулировать уровень персистирующей передачи сигналов BCR в В-клетках зародышевого центра, а не деактивировать передачу сигналов BCR в наивных В-клетках. Мы также заметили, что стимулирующие киназы и ингибирующие фосфатазы по-разному распределяются в выступах мембраны, даже если они активируются в GCBs одновременно. Активированные CD79, Syk и SHP1 заполняют контактную область мембранных выступов и внешний край контактной зоны, в то время как активированные Akt и SHIP1 проявляются в виде точек, редко украшая мембранные выступы и внешний край контактной зоны соответственно. Эти наблюдения предполагают, что GCBs организуют сигнальные молекулы в отдельные микрокластеры и поддерживают их для постоянной передачи сигналов через стручковидные выпячивания мембраны. Однако наши исследования с использованием TIRF были ограничены контактной мембраной GCB. Для полной визуализации и характеристики организации сигналосом GCB требуется трехмерное изображение с высоким разрешением.
Эти наблюдения предполагают, что GCBs организуют сигнальные молекулы в отдельные микрокластеры и поддерживают их для постоянной передачи сигналов через стручковидные выпячивания мембраны. Однако наши исследования с использованием TIRF были ограничены контактной мембраной GCB. Для полной визуализации и характеристики организации сигналосом GCB требуется трехмерное изображение с высоким разрешением.
WASp играет внутреннюю роль В-клеток в зародышевом центре, вызывая гиперпролиферацию GCB и дифференцировку плазматических клеток на моделях мышей с дефицитом WASp (Becker-Herman et al., 2011). Однако клеточный механизм, с помощью которого WASp регулирует созревание аффинности GCB, остается неясным. WASp активирует фактор нуклеации актина Arp2/3, расположенный ниже Cdc42 и фосфатидилинозитол-4,5-бифосфатов (Bi and Zigmond, 1999; Padrick and Rosen, 2010). Активированный Arp2/3 полимеризует разветвленные актиновые филаменты, которые, как известно, управляют ламеллиподиями мигрирующих и распространяющихся клеток (Bisi et al. , 2013; Alekhina et al., 2017). Поэтому неудивительно, что WASp вносит значительный вклад в распространение GCB на антигенпрезентирующих поверхностях, особенно в кинетике распространения.WASp играет аналогичную роль в наивных B-клетках (Liu et al., 2013a). Распространение расширяет контакт В-клеток с антигенпрезентирующими поверхностями, усиливая кластеризацию BCR и передачу сигналов (Fleire et al., 2006; Harwood and Batista, 2010).
, 2013; Alekhina et al., 2017). Поэтому неудивительно, что WASp вносит значительный вклад в распространение GCB на антигенпрезентирующих поверхностях, особенно в кинетике распространения.WASp играет аналогичную роль в наивных B-клетках (Liu et al., 2013a). Распространение расширяет контакт В-клеток с антигенпрезентирующими поверхностями, усиливая кластеризацию BCR и передачу сигналов (Fleire et al., 2006; Harwood and Batista, 2010).
В дополнение к его роли в распространении GCB, новый вывод этого исследования заключается в том, что WASp необходим для формирования и стабилизации стручковидных мембранных выпячиваний, уникальных мембранных структур GCB IS. WASp отвечает за образование и/или увеличение времени жизни актиновых фокусов, которые поддерживают выступы мембраны в центре контактной зоны GCB, поскольку количество актиновых фокусов и их относительное время жизни снижены в WKO GCB.Это открытие указывает на то, что актиновые структуры, поддерживающие стручковидные выпячивания мембраны, основаны на разветвленных актиновых сетях. Кроме того, WASp также необходим для стабильности и регулярности разветвленных актиновых структур на внешнем крае контактной мембраны GCB после быстрого распространения. Эти актиновые структуры, которые кажутся бегущими, функционируют для поддержания контактной области GCB и прилипания GCB к антигенпрезентирующим поверхностям, окружающим централизованные мембранные выступы. Роль этих актиновых структур в GCB противоположна тому, что наблюдалось в наивных B-клетках, где актин на внешнем крае контактной зоны вызывает сокращение B-клеток после распластывания, что способствует ослаблению передачи сигналов (Liu et al., 2013а; Сили-Фаллен и др., 2014). Это функциональное различие в актиновом цитоскелете между GCB и наивными B-клетками, вероятно, способствует их различным сигнальным сигнатурам BCR и повышенной способности GCB различать антигенсвязывающую аффинность по сравнению с наивными B-клетками (Khalil et al., 2012; Nowosad et al. и др., 2016; Квак и др., 2018; Луо и др., 2019). Роль WASp в генерации и поддержании актиновых структур, поддерживающих уникальную архитектуру GCB IS, может объяснить дефектную реакцию зародышевого центра у пациентов с WAS и на моделях мышей.
Кроме того, WASp также необходим для стабильности и регулярности разветвленных актиновых структур на внешнем крае контактной мембраны GCB после быстрого распространения. Эти актиновые структуры, которые кажутся бегущими, функционируют для поддержания контактной области GCB и прилипания GCB к антигенпрезентирующим поверхностям, окружающим централизованные мембранные выступы. Роль этих актиновых структур в GCB противоположна тому, что наблюдалось в наивных B-клетках, где актин на внешнем крае контактной зоны вызывает сокращение B-клеток после распластывания, что способствует ослаблению передачи сигналов (Liu et al., 2013а; Сили-Фаллен и др., 2014). Это функциональное различие в актиновом цитоскелете между GCB и наивными B-клетками, вероятно, способствует их различным сигнальным сигнатурам BCR и повышенной способности GCB различать антигенсвязывающую аффинность по сравнению с наивными B-клетками (Khalil et al., 2012; Nowosad et al. и др., 2016; Квак и др., 2018; Луо и др., 2019). Роль WASp в генерации и поддержании актиновых структур, поддерживающих уникальную архитектуру GCB IS, может объяснить дефектную реакцию зародышевого центра у пациентов с WAS и на моделях мышей. Дефицит WASp приводит к тому, что GCB генерируют меньше и/или относительно нестабильные выпячивания мембраны, что, вероятно, снижает способность GCB различать аффинность связывания антигена, вызывая неудачи в отборе высокоаффинных антиген-специфических B-клеток.
Дефицит WASp приводит к тому, что GCB генерируют меньше и/или относительно нестабильные выпячивания мембраны, что, вероятно, снижает способность GCB различать аффинность связывания антигена, вызывая неудачи в отборе высокоаффинных антиген-специфических B-клеток.
Уменьшение фосфорилирования BCR, кластеризации BCR и распространения клеток в GCB WKO по сравнению с GCB WT предполагает, что WASp способствует активации BCR за счет увеличения распространения клеток и кластеризации BCR в зоне контакта. Эти результаты аналогичны тем, что мы наблюдали в нативных В-клетках WKO (Liu et al., 2013a), предполагая общую роль WASp в наивных B-клетках и GCB, помимо его GCB-специфических функций. Используя визуализацию отдельных молекул, мы недавно показали, что подвижность поверхностных BCR значительно ниже в нативных В-клетках WKO, чем в наивных В-клетках WT (Rey-Suarez et al., 2020), что подразумевает, что WASp способствует кластеризации BCR путем мобилизации BCR. на поверхности В-клеток. Интересно, что наряду со сниженной кластеризацией и активацией BCR в GCB WKO уровни двух основных фосфатаз в зоне контакта изменяются по-разному, при этом pSHIP1 увеличивается, а pSHP1 снижается, что позволяет предположить, что WASp по-разному регулирует эти две фосфатазы. Значение таких противоположных изменений активации SHIP1 и SHP1 в GCB WKO неизвестно. Мы также заметили, что влияние WASp-дефицита на организацию микросигнальных кластеров намного больше, чем его влияние на уровень проксимальной передачи сигналов BCR. Это, вероятно, является результатом насыщенной силы активации относительно высокой плотностью Fab’ на PLB, преодолевая дефекты передачи сигналов, вызванные дефицитом WASp. Будущие исследования с градуированной плотностью и аффинностью антигена дополнительно раскроют механизм, с помощью которого WASp регулирует созревание аффинности GCB.
Значение таких противоположных изменений активации SHIP1 и SHP1 в GCB WKO неизвестно. Мы также заметили, что влияние WASp-дефицита на организацию микросигнальных кластеров намного больше, чем его влияние на уровень проксимальной передачи сигналов BCR. Это, вероятно, является результатом насыщенной силы активации относительно высокой плотностью Fab’ на PLB, преодолевая дефекты передачи сигналов, вызванные дефицитом WASp. Будущие исследования с градуированной плотностью и аффинностью антигена дополнительно раскроют механизм, с помощью которого WASp регулирует созревание аффинности GCB.
Умеренное снижение распространения клеток, кластеризации BCR и передачи сигналов в GCB WKO указывает на то, что WASp не является существенным для передачи сигналов BCR в GCB. В семейство WASp входят дополнительные члены, включая N-WASp и WAVE, которые все могут активировать Arp2/3-опосредованную полимеризацию разветвленного актина (Padrick and Rosen, 2010; Oda and Eto, 2013; Alekhina et al., 2017). Ранее мы показали, что и WASp, и N-WASp необходимы для распространения клеток, кластеризации BCR и передачи сигналов в наивных B-клетках. Наивные B-клетки от мышей с двойным нокаутом WASp и N-WASp (специфических для B-клеток) не могут распространяться, кластеризовать поверхностные BCR и активировать BCR при взаимодействии с одним и тем же Fab’-PLB (Liu et al., 2013а). Эти результаты предполагают, что N-WASp может функционально компенсировать отсутствие WASp в GCB, но не может исключить возможную роль WAVE в GCB. Как эти факторы, способствующие нуклеации актина, работают вместе в GCBs, чтобы способствовать созреванию аффинности, является предметом нашего будущего интереса.
Ранее мы показали, что и WASp, и N-WASp необходимы для распространения клеток, кластеризации BCR и передачи сигналов в наивных B-клетках. Наивные B-клетки от мышей с двойным нокаутом WASp и N-WASp (специфических для B-клеток) не могут распространяться, кластеризовать поверхностные BCR и активировать BCR при взаимодействии с одним и тем же Fab’-PLB (Liu et al., 2013а). Эти результаты предполагают, что N-WASp может функционально компенсировать отсутствие WASp в GCB, но не может исключить возможную роль WAVE в GCB. Как эти факторы, способствующие нуклеации актина, работают вместе в GCBs, чтобы способствовать созреванию аффинности, является предметом нашего будущего интереса.
Таким образом, это исследование определило роль WASp и WASp-активируемой полимеризации разветвленного актина в генерации и поддержании уникальной архитектуры GCB IS. Эта уникальная архитектура необходима для того, чтобы GCB различали аффинность связывания антигена для отбора высокоаффинных антиген-специфических B-клеток для усиления ответов антител. Дефектная архитектура GCB IS обеспечивает клеточный механизм, с помощью которого дефицит WASp вызывает иммунные нарушения.
Дефектная архитектура GCB IS обеспечивает клеточный механизм, с помощью которого дефицит WASp вызывает иммунные нарушения.
Заявление о доступности данных
Оригинальные вклады, представленные в исследовании, включены в статью/дополнительный материал, дальнейшие запросы можно направлять соответствующим авторам.
Заявление об этике
Исследование на животных было рассмотрено и одобрено Институциональным комитетом по уходу и использованию животных (IACUC) Университета Мэриленда (Колледж-Парк, Мэриленд, США) и Медицинского университета Чунцина (Чунцин, Китай).
Вклад авторов
YL, WS, AU и XZ установили план исследования и предоставили стратегию исследования. YL и AB провели эксперименты и анализ данных. YL и WS подготовили и написали рукопись. Все авторы прочитали и одобрили рукопись.
Финансирование
Эта работа была поддержана грантом R01 GM064625 Национального института здравоохранения США для WS. YL был поддержан грантом Национального научного фонда Китая № 8161001201 для XZ. AU был поддержан грантом Национального научного фонда США PHY 1
AU был поддержан грантом Национального научного фонда США PHY 1
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могли бы быть истолкованы как потенциальный конфликт интересов.
Благодарности
Мы благодарим доктора. A. Beaven (центр визуализации CBMG, Университет Мэриленда) и K. Class (центр проточной цитометрии CBMG, Университет Мэриленда) за помощь в конфокальной микроскопии и проточной цитометрии, а также членам лабораторий Song и Zhao за полезные обсуждения.
Дополнительный материал
Дополнительный материал к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fcell.2021.646077/full#supplementary-material
.Ссылки
Аллен, К.Д., Ансель, К.М., Лоу, К., Лесли, Р., Тамамура, Х., Фуджи, Н., и соавт. (2004). Организация темной и светлой зоны зародышевого центра опосредована CXCR4 и CXCR5. Нац. Иммунол. 5, 943–952. дои: 10.1038/ni1100
Нац. Иммунол. 5, 943–952. дои: 10.1038/ni1100
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Авалос, А.M., и Ploegh, HL (2014). Ранние события BCR и захват, обработка и загрузка антигена на MHC класса II на B-клетках. Перед. Иммунол. 5:92. doi: 10.3389/fimmu.2014.00092
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Батиста, Ф.Д., и Нойбергер, М.С. (2000). В-клетки извлекают и представляют иммобилизованный антиген: последствия для аффинной дискриминации. EMBO J. 19, 513–520. doi: 10.1093/emboj/19.4.513
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Беккер-Херман, С., Meyer-Bahlburg, A., Schwartz, M.A., Jackson, S.W., Hudkins, K.L., Liu, C., et al. (2011). WASp-дефицитные В-клетки играют критическую, внутренне присущую клеткам роль в запуске аутоиммунитета. Дж. Экспл. Мед. 208, 2033–2042 гг. doi: 10.1084/jem.20110200
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Би, Э. , и Зигмонд, С.Х. (1999). Полимеризация актина: куда жалит WASP. Курс. биол. 9, Р160–Р163.
, и Зигмонд, С.Х. (1999). Полимеризация актина: куда жалит WASP. Курс. биол. 9, Р160–Р163.
Академия Google
Бизи, С., Disanza, A., Malinverno, C., Frittoli, E., Palamidessi, A., and Scita, G. (2013). Динамика мембран и актина взаимодействует на переднем крае ламеллиподий. Курс. мнение Клеточная биол. 25, 565–573. doi: 10.1016/j.ceb.2013.04.001
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Бостикардо, М., Марангони, Ф., Айути, А., Вилла, А., и Грация Ронкароло, М. (2009). Последние достижения в понимании патофизиологии синдрома Вискотта-Олдрича. Кровь 113, 6288–6295.doi: 10.1182/blood-2008-12-115253
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Браувайлер, А. М., Тамир, И., и Камбье, Дж. К. (2000). Двухуровневый контроль активации В-клеток с помощью инозитол-5-фосфатазы SHIP. Иммунол. Ред. 176, 69–74.
Академия Google
Катон, М. Х., Яу, И. В., и Рикерт, Р. К. (2011). Магнитная очистка нетронутых В-клеток зародышевого центра мыши для манипуляций ex vivo и биохимического анализа. Нац. протокол 6, 953–960. doi: 10.1038/nprot.2011.344
Х., Яу, И. В., и Рикерт, Р. К. (2011). Магнитная очистка нетронутых В-клеток зародышевого центра мыши для манипуляций ex vivo и биохимического анализа. Нац. протокол 6, 953–960. doi: 10.1038/nprot.2011.344
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Cheng, P.C., Dykstra, M.L., Mitchell, R.N., and Pierce, S.K. (1999). Роль липидных рафтов в передаче сигналов рецептора антигена В-клеток и нацеливании на антиген. Дж. Экспл. Мед. 190, 1549–1560.
Академия Google
Дал Порто, Дж. М., Голд, С. Б., Меррелл, К. Т., Миллс, Д., Пью-Бернард, А. Э., и Камбье, Дж. (2004).Передача сигналов В-клеточного антигенного рецептора 101. Mol. Иммунол. 41, 599–613. doi: 10.1016/j.molimm.2004.04.008
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Depoil, D., Weber, M., Treanor, B., Fleire, S.J., Carrasco, Y.R., Harwood, N.E., et al. (2009). Ранние события активации В-клеток антигеном. науч. Сигнал. 2: часть 1. doi: 10.1126/scisignal.263pt1
науч. Сигнал. 2: часть 1. doi: 10.1126/scisignal.263pt1
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Флер, С.Дж., Голдман, Дж. П., Карраско, Ю. Р., Вебер, М., Брей, Д., и Батиста, Ф. Д. (2006). Дискриминация лигандов В-клеток посредством реакции расширения и сокращения. Наука 312, 738–741. doi: 10.1126/наука.1123940
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Фримен С.А., Лей В., Данг-Лоусон М., Мизуно К., Роскелли С.Д. и Голд М.Р. (2011). Опосредованное кофилином расщепление F-актина регулируется Rap GTPase и контролирует динамику цитоскелета, которая управляет распространением лимфоцитов и образованием микрокластеров BCR. Дж. Иммунол. 187, 5887–5900. doi: 10.4049/jimmunol.1102233
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Гитлин, А. Д., Шульман, З., и Нуссенцвейг, М. К. (2014). Клональная селекция в центре зародыша путем регулируемой пролиферации и гипермутации. Природа 509, 637–640. doi: 10.1038/nature13300
Природа 509, 637–640. doi: 10.1038/nature13300
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Харвуд, Н. Э., и Батиста, Ф. Д. (2011). Цитоскелет координирует ранние события активации В-клеток. Гавань Колд Спринг. Перспектива. биол. 3:а002360. doi: 10.1101/cshperspect.a002360
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Хугебум, Р., и Толар, П. (2016). Молекулярные механизмы сбора В-клеточных антигенов и эндоцитоза. Курс. Вверх. микробиол. Иммунол. 393, 45–63. дои: 10.1007/82_2015_476
Полнотекстовая перекрестная ссылка | Академия Google
Халил, А. М., Камбье, Дж. К., и Шломчик, М. Дж. (2012). Передача сигнала В-клеточного рецептора в GC закорочена высокой активностью фосфатазы. Наука 336, 1178–1181. doi: 10.1126/science.1213368
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Колхаткар, Н. С., Брахмандам, А. , Тувенель, С. Д., Беккер-Херман, С., Джейкобс, Х. М., Шварц, М. А., и соавт. (2015). Измененные сигналы BCR и TLR способствуют усиленному положительному отбору аутореактивных переходных В-клеток при синдроме Вискотта-Олдрича. Дж. Экспл. Мед. 212, 1663–1677. doi: 10.1084/jem.20150585
, Тувенель, С. Д., Беккер-Херман, С., Джейкобс, Х. М., Шварц, М. А., и соавт. (2015). Измененные сигналы BCR и TLR способствуют усиленному положительному отбору аутореактивных переходных В-клеток при синдроме Вискотта-Олдрича. Дж. Экспл. Мед. 212, 1663–1677. doi: 10.1084/jem.20150585
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Куйперс, Т.W., Tool, A.T.J., van der Bijl, I., de Boer, M., van Houdt, M., de Cuyper, I.M., et al. (2017). Комбинированный иммунодефицит с выраженным воспалением и аллергией, вызванный дефицитом ARPC1B. J. Аллергическая клиника. Иммунол. 140, 273–277.e10. doi: 10.1016/j.jaci.2016.09.061
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Квак, К., Кизон, Н., Сон, Х., Сание, А., Манцелла-Лапейра, Дж., Холла, П., и др. (2018). Внутренние свойства В-клеток зародышевого центра человека устанавливают пороги сродства к антигенам. науч. Иммунол. 3:eaau6598. doi: 10. 1126/sciimmunol.aau6598
1126/sciimmunol.aau6598
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лам Хуэй, К., Ван, К., Груман, Б., Уэйт, Дж., и Упадхьяя, А. (2012). Мембранная динамика коррелирует с образованием сигнальных кластеров во время распластывания клеток. Биофиз. Дж. 102, 1524–1533. doi: 10.1016/j.bpj.2012.02.015
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лю, К., Бай, X., Ву, Дж., Шарма, С., Upadhyaya, A., Dahlberg, C.I., et al. (2013а). N-WASP необходим для негативной регуляции передачи сигналов рецептора В-клеток. PLoS Биол. 11:e100170. doi: 10.1371/journal.pbio.1001704
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лю, К., Фоллен, М.К., Миллер, Х., Упадхьяя, А., и Сонг, В. (2013b). Актиновый цитоскелет координирует функции передачи сигнала и процессинга антигена антигенного рецептора В-клетки. Перед. биол. 8: 475–485.doi: 10.1007/s11515-013-1272-0
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лю, К. , Миллер, Х., Хуэй, К.Л., Груман, Б., Болланд, С., Упадхьяя, А., и соавт. (2011). Баланс тирозинкиназы Брутона и активации SHIP регулирует формирование кластера рецепторов В-клеток, контролируя ремоделирование актина. Дж. Иммунол. 187, 230–239. doi: 10.4049/jimmunol.1100157
, Миллер, Х., Хуэй, К.Л., Груман, Б., Болланд, С., Упадхьяя, А., и соавт. (2011). Баланс тирозинкиназы Брутона и активации SHIP регулирует формирование кластера рецепторов В-клеток, контролируя ремоделирование актина. Дж. Иммунол. 187, 230–239. doi: 10.4049/jimmunol.1100157
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Лю, К., Миллер Х., Орловски Г., Ханг Х., Упадхьяя А. и Сонг В. (2012). Реорганизация актина необходима для образования сигналосом поляризованных В-клеточных рецепторов в ответ как на растворимые, так и на ассоциированные с мембраной антигены. Дж. Иммунол. 188, 3237–3246. doi: 10.4049/jimmunol.1103065
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Luo, W., Hawse, W., Conter, L., Trivedi, N., Weisel, F., Wikenheiser, D., et al. (2019). Сеть передачи сигналов киназы AKT перестроена PTEN для контроля проксимальной передачи сигналов BCR в B-клетках зародышевого центра. Нац. Иммунол. 20, 736–746. doi: 10.1038/s41590-019-0376-3
Иммунол. 20, 736–746. doi: 10.1038/s41590-019-0376-3
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Новосад, Ч. Р., Спиллейн, К. М., и Толар, П. (2016). В-клетки зародышевого центра распознают антиген через специализированную архитектуру иммунного синапса. Нац. Иммунол. 17, 870–877. doi: 10.1038/ni.3458
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Падрик, С. Б., и Розен, М. К. (2010). Физические механизмы интеграции сигналов белками семейства WASP. год. Преподобный Биохим. 79, 707–735. doi: 10.1146/annurev.biochem.77.060407.135452
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Пелузо, П., Уилсон, Д.С., До, Д., Тран, Х., Венкатасуббайа, М., Куинси, Д., и соавт. (2003). Оптимизация стратегий иммобилизации антител для построения белковых микрочипов. Анал. Биохим. 312, 113–124. doi: 10.1016/s0003-2697(02)00442-6
Полнотекстовая перекрестная ссылка | Академия Google
Речер, М. , Бернс, С.О., де ла Фуэнте, М.А., Вольпи, С., Дальберг, К., и Уолтер, Дж.Э. (2012). Присущий В-клеткам дефицит белка синдрома Вискотта-Олдрича (WASp) вызывает серьезные аномалии периферического В-клеточного компартмента у мышей. Кровь 119, 2819–2828. дои: 10.1182/кровь-2011-09-379412
, Бернс, С.О., де ла Фуэнте, М.А., Вольпи, С., Дальберг, К., и Уолтер, Дж.Э. (2012). Присущий В-клеткам дефицит белка синдрома Вискотта-Олдрича (WASp) вызывает серьезные аномалии периферического В-клеточного компартмента у мышей. Кровь 119, 2819–2828. дои: 10.1182/кровь-2011-09-379412
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Рей-Суарес, И., Уитли, Б.А., Ку, П., Бханджа, А., Шу, З., Мокри, С., и другие. (2020). Белки семейства WASP регулируют подвижность рецептора В-клеток во время активации передачи сигнала. Нац. коммун. 11:439. doi: 10.1038/s41467-020-14335-8
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Riedl, J., Crevenna, A.H., Kessenbrock, K., Yu, J.H., Neukirchen, D., Bista, M., et al. (2008). Lifeact: универсальный маркер для визуализации F-актина. Нац. Методы 5, 605–607. doi: 10.1038/nmeth.1220
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сили-Фаллен, М. К., Лю, Л. Дж., Шапиро, М. Р., Онабахо, О.О., Паланиенди С., Чжу Х. и соавт. (2014). Актин-связывающий белок 1 связывает антигенные рецепторы В-клеток с негативными сигнальными путями. Проц. Натл. акад. науч. США 111, 9881–9886. doi: 10.1073/pnas.1321971111
К., Лю, Л. Дж., Шапиро, М. Р., Онабахо, О.О., Паланиенди С., Чжу Х. и соавт. (2014). Актин-связывающий белок 1 связывает антигенные рецепторы В-клеток с негативными сигнальными путями. Проц. Натл. акад. науч. США 111, 9881–9886. doi: 10.1073/pnas.1321971111
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Шломчик, М. Дж., и Вайзель, Ф. (2012). Селекция зародышевых центров и развитие клеток памяти В и плазматических клеток. Иммунол. Ред. 247, 52–63. doi: 10.1111/j.1600-065X.2012.01124.х
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Саймон К.Л., Андерсон С.М., Гарабедян Э.К., Моратто Д., Соколич Р.А. и Кандотти Ф. (2014). Молекулярные и фенотипические аномалии В-лимфоцитов у пациентов с синдромом Вискотта-Олдрича. J. Аллергическая клиника. Иммунол. 133, 896–9.e4. doi: 10.1016/j.jaci.2013.08.050
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сон, Х. В., Толар, П., и Пирс, С.К.(2008). Мембранные неоднородности в формировании микрокластеров В-клеточного рецептора-Lyn kinase и иммунного синапса. J. Cell Biol. 182, 367–379. doi: 10.1083/jcb.200802007
В., Толар, П., и Пирс, С.К.(2008). Мембранные неоднородности в формировании микрокластеров В-клеточного рецептора-Lyn kinase и иммунного синапса. J. Cell Biol. 182, 367–379. doi: 10.1083/jcb.200802007
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Сонг В., Лю К., Сили-Фаллен М. К., Миллер Х., Кетчум К. и Упадхьяя А. (2013). Актин-опосредованные петли обратной связи в передаче сигналов рецептора В-клеток. Иммунол. Ред. 256, 177–189. doi: 10.1111/imr.12113
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Толар, с., Ханна, Дж., Крюгер, П.Д., и Пирс, С.К. (2009). Константная область мембранного иммуноглобулина опосредует кластеризацию рецепторов В-клеток и передачу сигналов в ответ на мембранные антигены. Иммунитет 30, 44–55. doi: 10.1016/j.immuni.2008.11.007
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Treanor, B., Depoil, D., Gonzalez-Granja, A. , Barral, P., Weber, M., Dshek, O., et al. (2010). Скелет мембраны контролирует динамику диффузии и передачу сигналов через В-клеточный рецептор. Иммунитет 32, 187–199. doi: 10.1016/j.immuni.2009.12.005
, Barral, P., Weber, M., Dshek, O., et al. (2010). Скелет мембраны контролирует динамику диффузии и передачу сигналов через В-клеточный рецептор. Иммунитет 32, 187–199. doi: 10.1016/j.immuni.2009.12.005
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Тернер, Дж. С., Ке, Ф., и Григорова, И. Л. (2018). Сшивание рецепторов В-клеток увеличивает выбор В-клеток зародышевого центра, когда помощь Т-клеток ограничена. Cell Rep. 25, 1395–1403.e4. doi: 10.1016/j.celrep.2018.10.042
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
Volpi, S., Cicalese, M.P., Tuijnenburg, P., Tool, A.T.J., Cuadrado, E., Abu-Halaweh, M., et al. (2019). Комбинированный иммунодефицит с тяжелыми инфекциями, воспалением и аллергией, вызванный дефицитом ARPC1B. J. Аллергическая клиника. Иммунол. 143, 2296–2299. doi: 10.1016/j.jaci.2019.02.003
Реферат PubMed | Полный текст перекрестной ссылки | Академия Google
EBV microRNA-BHRF1-2-5p нацелены на 3’UTR лигандов иммунных контрольных точек PD-L1 и PD-L2
https://doi. org/10.1182/blood.201
org/10.1182/blood.20189Get rights and content -положительные (EBV
+ ) диффузные крупноклеточные В-клеточные лимфомы (DLBCL) экспрессируют высокие уровни лиганда запрограммированной смерти 1 (PD-L1) и PD-L2.Регуляция микроРНК (миР) является важным механизмом тонкой настройки экспрессии генов посредством нацеливания на 3′-нетранслируемую область (3’UTR), и ранее мы продемонстрировали сильную экспрессию миР EBV в EBV + DLBCL. В то время как известно, что латентный мембранный белок-1 ВЭБ (LMP1) индуцирует PD-L1/L2, потенциальная контррегуляторная роль миР ВЭБ в тонкой настройке экспрессии PD-L1/L2 еще предстоит установить. Чтобы изучить это, была разработана новая модель EBV + DLBCL in vitro с использованием вирусного штамма EBV WIL, который, в отличие от обычных лабораторных штаммов, сохраняет интактные некодирующие области, где находится несколько миР EBV.Это позволило выяснить взаимосвязь между генами латентности EBV, клетками происхождения (COO), PD-L1, PD-L2 и миР EBV. Модель успешно воспроизвела весь спектр дифференцировки В-клеток с 4 дискретными фазами COO: ранние и поздние В-клетки зародышевого центра (GCB) и ранние и поздние активированные В-клетки (ABC). Интересно, что уровни PD-L1/L2 заметно увеличивались при переходе от поздней фазы GCB к ранней ABC-фазе после активации LMP1. EBV miR – BamHI фрагмент H, открытая вправо рамка считывания 1 (BHRF1)–2-5p, сгруппированная отдельно от других EBV miR, поднимающаяся во время поздней фазы GCB.Биоинформационное прогнозирование вместе с функциональной проверкой подтвердило, что миР-BHRF1-2-5p EBV связывается с 3’UTR PD-L1 и PD-L2 для снижения экспрессии поверхностных белков PD-L1/L2. Результаты указывают на новый механизм, с помощью которого EBV miR-BHRF1-2-5p играет контекстно-зависимую контррегуляторную роль для точной настройки экспрессии LMP1-управляемой амплификации этих лигандов ингибирующих контрольных точек. Дальнейшая идентификация miRs, нацеленных на иммунные контрольные точки, может привести к появлению потенциальных новых методов лечения на основе РНК.
Модель успешно воспроизвела весь спектр дифференцировки В-клеток с 4 дискретными фазами COO: ранние и поздние В-клетки зародышевого центра (GCB) и ранние и поздние активированные В-клетки (ABC). Интересно, что уровни PD-L1/L2 заметно увеличивались при переходе от поздней фазы GCB к ранней ABC-фазе после активации LMP1. EBV miR – BamHI фрагмент H, открытая вправо рамка считывания 1 (BHRF1)–2-5p, сгруппированная отдельно от других EBV miR, поднимающаяся во время поздней фазы GCB.Биоинформационное прогнозирование вместе с функциональной проверкой подтвердило, что миР-BHRF1-2-5p EBV связывается с 3’UTR PD-L1 и PD-L2 для снижения экспрессии поверхностных белков PD-L1/L2. Результаты указывают на новый механизм, с помощью которого EBV miR-BHRF1-2-5p играет контекстно-зависимую контррегуляторную роль для точной настройки экспрессии LMP1-управляемой амплификации этих лигандов ингибирующих контрольных точек. Дальнейшая идентификация miRs, нацеленных на иммунные контрольные точки, может привести к появлению потенциальных новых методов лечения на основе РНК.
Рекомендованные статьи со ссылками на статьи (0) Генетический реагент ( Drosophila
melanogaster )
; генотип: y[*] w[*];
P{RedH-Пеликан.org-1-HN18-dsRed,
w[+mC]}18a, P{pGD130.tinC*-GFP,
y[+]}13b, P{RedH-Pelican.HLH54Fb-
dsRed, w[+mC] }16b
P{RedH-Pelican.org-1-HN18-dsRed,
w[+mC]}18a, P{pGD130.tinC*-GFP,
y[+]}13b, P{RedH-Pelican.HLH54Fb-
dsRed, w[+mC]}16 c
фондовый центр
 1
1 фон
фон
Stock Center
FBal0057093
pCaSpeR4-X18C12-edl_rescue; линия №
BS12 несет P{edl.AF1} на
Chromosome 3
фондовый центр
 melanogaster )
melanogaster )Фон
 Melanogaster )
Melanogaster )Сток-центр
Фондовый центр
 melanogaster )
melanogaster )фондовый центр
PMID: 18327265
 1
1 Stock Center
FBAL0016005
фондовый центр
 melanogaster )
melanogaster )УАС-ЕгфрДН.Б-29-8-1’;
2x EGFR[DN]
Stock Center
фондовый центр
PMID: 11051548
фондовый центр
фондовый центр
 melanogaster )
melanogaster )фондовый центр
BDSC: 8858
Stock Center
PMID: 11404079
( D. melanogaster )
PMID: 16221729
( D.Melanogaster )
фондовый центр
( D. Melanogaster )
Center
 Melanogaster )
Melanogaster )фондовый центр
( Д.Melanogaster )
Сток-центр
( D. Melanogaster )
Центр
фондовый центр
( д.Melanogaster )
BDSC: 42680
для генерации P {EDL.
 AF1}
AF1}(морская свинка поликлональная)
PMID: 145
(поликлональные морские свинки)
PMID: 145
(кроличьи поликлональные)
PMID: 145
(кроличьи поликлональные)
PMID: 12756183
(кроличьи поликлональные)
 T. NGUYEN
T. NGUYEN(крыса Поликлональная)
(кролик поликлональная)
(кроличьи поликлональные)
PMID: 9435286
(Mouse Monoclonal)
Hybridoma Bank
(мыши моноклональные)

1a (мышиное моноклональное)
Hybridoma Bank
(кролик поликлональный)
зонды: A6455
(кролик поликлональный)
: # 9661
(овечья поликлональная)
Анализ или комплект
ABC-HRP Kit
Аналис или комплект
Усиление (TSA)
Reagent CY3
ASTAY или KIT
Усиление (TSA)
FluorsceIn
SAT70100155
Asoptose
Комплект обнаружения
Купить Австралия CBS 3 x 🔥🔥 🔥 Triple Deluxe BOOSTER (новая улучшенная формула)
Купите Australia cbs 3 x 🔥🔥🔥 тройной люкс BOOSTER (новая улучшенная формула) в Shopee Malaysia по доступной цене и с максимальной гарантией. Вы можете получить экстраординарные предложения и сэкономить -10% при покупке этого товара на распродаже сегодня.
Вы можете получить экстраординарные предложения и сэкономить -10% при покупке этого товара на распродаже сегодня.
Мы предлагаем историю цен Австралия cbs 3 x 🔥🔥🔥 тройной люкс BOOSTER (новая улучшенная формула).
Хорошие новости! Новая версия дает лучший результат, потому что мы добавили экстракт фасоли адзуки (чтобы избавиться от задержки воды, 身体水肿,多余水分,湿气, а также с высоким содержанием белка) ХАЛЯЛ сертифицирован!
Рекомендую принять 1 набор для лечения (2 флакона) 💝 Зачем вам этот новый номер Australia CBS Triple Deluxe? 1) Застойный вес, независимо от того, как вы сидите на диете или с другими продуктами для похудения, вы просто не можете сбросить лишние килограммы, как бы вы ни старались.Австралия CBS Triple Deluxe с добавлением 3 новых натуральных ингредиентов для сжигания жира, комплекса витаминов группы В для более энергичного дня, и даже наша капсула изготовлена из натуральной пищевой растительной основы без добавления искусственных химических красителей. 2) Если вы хотите наслаждаться едой, но беспокоитесь о прибавке в весе, с Australia CBS Triple Deluxe можно сжигать до 1800 калорий в день, теперь вы можете наслаждаться вкусной едой, не беспокоясь.
3) Австралия CBS Triple Deluxe эффективно облегчает запоры и одновременно избавляет ваше тело от токсинов и жира.4) Когда у вас тусклая кожа, Australia CBS Triple Deluxe может помочь сделать вашу кожу ярче и сияющей благодаря своей суперэффективности в детоксикации и содержит кетон малины с высоким содержанием витамина С для отбеливания кожи.
5) Когда вы хотите получить полезный и эффективный продукт для похудения по разумной цене. Это ваш лучший окончательный выбор! 👍🏼 ✔️ Результат в 2 раза быстрее, чем предыдущий CBS
✔️ Более сильная улучшенная формула с добавлением 3 новых натуральных ингредиентов для сжигания жира (корица, кардамон и водоросли).
✔️ С добавлением комплекса витаминов группы В.
Корица —
Сжигая больше калорий, увеличивайте скорость метаболизма до 50% в нашем организме, поэтому этот новый CBS Triple Deluxe заставит наше тело сжигать больше жира таким образом.
2) Если вы хотите наслаждаться едой, но беспокоитесь о прибавке в весе, с Australia CBS Triple Deluxe можно сжигать до 1800 калорий в день, теперь вы можете наслаждаться вкусной едой, не беспокоясь.
3) Австралия CBS Triple Deluxe эффективно облегчает запоры и одновременно избавляет ваше тело от токсинов и жира.4) Когда у вас тусклая кожа, Australia CBS Triple Deluxe может помочь сделать вашу кожу ярче и сияющей благодаря своей суперэффективности в детоксикации и содержит кетон малины с высоким содержанием витамина С для отбеливания кожи.
5) Когда вы хотите получить полезный и эффективный продукт для похудения по разумной цене. Это ваш лучший окончательный выбор! 👍🏼 ✔️ Результат в 2 раза быстрее, чем предыдущий CBS
✔️ Более сильная улучшенная формула с добавлением 3 новых натуральных ингредиентов для сжигания жира (корица, кардамон и водоросли).
✔️ С добавлением комплекса витаминов группы В.
Корица —
Сжигая больше калорий, увеличивайте скорость метаболизма до 50% в нашем организме, поэтому этот новый CBS Triple Deluxe заставит наше тело сжигать больше жира таким образом. Кардамон —
Улучшите нашу пищеварительную систему и нацельтесь на раздутый живот или жир в нижней части тела, особенно эффективен для сжигания жира на животе и называется «Атакующий естественным жиром» для человеческого организма.
Келп —
Супер блокатор жира, высокое содержание клетчатки и поглощение жира из запасов в нашем организме, поэтому вы теряете больше калорий каждый день, снижаете поглощение калорий до 75% и заставляете вас чувствовать себя более сытым.
✔️ Стимулируйте свой биоэнергетический режим
✔️ Никакой тяжелой диареи, никаких тяжелых упражнений, никакой специальной диеты!
✔️ ️Соответствует требованиям безопасности FDA США.
✔️ Одобрено GMP и HACCP.
✔️ Проверенные результаты и множество историй успеха от наших любимых клиентов!
✔️ Изготовлен из растительных ингредиентов.
✔️ Сжигает лишний жир, повышает скорость метаболизма и снижает всасывание холестерина.
✔️ Похудеть в следующих областях: Тело, Лицо, Бедра, Бедра, Руки
✔️ Может помочь синхронизировать гормоны и устранить прыщи
✔️ Является самым продаваемым продуктом с 2009 года.
Кардамон —
Улучшите нашу пищеварительную систему и нацельтесь на раздутый живот или жир в нижней части тела, особенно эффективен для сжигания жира на животе и называется «Атакующий естественным жиром» для человеческого организма.
Келп —
Супер блокатор жира, высокое содержание клетчатки и поглощение жира из запасов в нашем организме, поэтому вы теряете больше калорий каждый день, снижаете поглощение калорий до 75% и заставляете вас чувствовать себя более сытым.
✔️ Стимулируйте свой биоэнергетический режим
✔️ Никакой тяжелой диареи, никаких тяжелых упражнений, никакой специальной диеты!
✔️ ️Соответствует требованиям безопасности FDA США.
✔️ Одобрено GMP и HACCP.
✔️ Проверенные результаты и множество историй успеха от наших любимых клиентов!
✔️ Изготовлен из растительных ингредиентов.
✔️ Сжигает лишний жир, повышает скорость метаболизма и снижает всасывание холестерина.
✔️ Похудеть в следующих областях: Тело, Лицо, Бедра, Бедра, Руки
✔️ Может помочь синхронизировать гормоны и устранить прыщи
✔️ Является самым продаваемым продуктом с 2009 года.







